Arterial Spin Labeling perfuzija - klinička primena
vanredni profesor dr sc. Jelena Ostojić medicinski fizičar specijalista
Arterial Spin Labeling (ASL) je MR imidžing tehnika koja omogućava neinvazivno merenje perfuzije u tkivu. U osnovi ove tehnike je magnetno obeležavanje protona u arterijskoj krvi pre njenog dolaska u tkivo od interesa. Na taj način voda u arterijskoj krvi omogućava merenje tkivne perfuzije i zamenjuje endogeni kontrast. ASL obezbeđuje informacije o perfuziji mozga bez primene kontrasta. Zahvaljujući ovoj prednosti ASL, moguće je snimiti perfuziju i kod osoba koje imaju kontraindikacije za primenu kontrasta, kao što je bubrežna insuficijencija. Primenom ASL se jednostavnije kvantifikuje Cerebral Blood Flow (CBF) u poređenju sa kontrastnim tehnikama kao što je Dynamic Susceptibility Contrast (DSC). ASL perfuzija je pogodna za primenu kod dece jer nema tehničkih i etičkih problema zbog primene kontrasta, izlaganja zračenju na CT ili korišćenja tehnika nuklearne medicine.
Primena ASL u neurodegenerativnim bolestima
Opšta razmatranja
Prema modelu neurodegeneracije po autorima Jack et al (1), promene metabolizma mozga prethode strukturnim promenama tokom kognitivnog pada u Alchajmerovoj demenciji. To objašnjava veliki interes za ispitivanje metabolizma glukoze u mozgu primenom pozitronske emisione tomografije (PET) sa fluordezoksiglukozom (FDG). Ovom tehnikom su utvrđeni različiti obrasci promena metabolizma kod različitih tipova demencija. Na primer kod Alchajmerove demencije je tipičan hipometabolizam u bilateralnim parijetalnim i temporalnim regijama, dok je okcipitalni lobus očuvan. Demencija sa Levijevim telima (Lewy bodies) ima bilateralni parijetalni, temporalni i dodatno okcipitalni hipometabolizam (2). Pored velikih doza zračenja kojima su izloženi pacijenti tokom snimanja na PET-u, drugi nedostatak je niska specifičnost navedenih promena za određenu bolest kada se koristi fluordezoksiglukoza (FDG). Zbog toga su se razvili izotopi koji su specifični za određene bolesti: amiloidni i tau PET ali ovi izotopi nisu dostupni u našoj zemlji (radi se samo FDG PET u Novom Sadu i Beogradu). Zbog svega navedenog, postoji potreba za alternativnom tehnikom koja može da zameni FDG PET u dijagnozi i praćenju demencije. Magnetnorezonantna (MR) ASL tehnika perfuzije nudi dobru alternativu iz više razloga. Prvo, perfuzija i metabolizam mozga su direktno povezani (3,4) tako da obrasci hipometabolizma na FDG PET-u kod određenih demencija mogu da se posmatraju kao obrasci hipoperfuzije na ASL MR imidžima. U brojnoj literaturi je prikazana visoka korelacija između perfuzije mozga merene primenom ASL (5-9) i merenja metabolizma mozga upotrebom FDG PET (10-13) kod blagog kognitivnog oštećenja i Alchajmerove demencije. Konvencionalni (strukturalni) MR imidžing se rutinski primenjuje kod mnogih pacijenata u procedurama ispitivanja i praćenja kognitivnog pada. Dodavanje ASL sekvence postojećem MR protokolu znači samo dodatnih 4-5 minuta snimanja, nije potreban kontrast, cena pregleda je znatno manja u poređenju sa PET-om, a velika prednost je u tome što se pacijenti ne izažu zračenju. Na taj način dobijamo informacije o strukturi i perfuziji mozga u jednom snimanju. Rađene su brojne ASL studije normalnog starenja. Kod ispitanika koji su razvili kognitivni pad u periodu između dva snimanja je ASL perfuzija u posteriornom cingularnom korteksu niska i na prvom pregledu što govori o prognostičkoj vrednosti ASL perfuzije.
Alchajmerova bolest i blago kognitivno oštećenje
U Alchajmerovoj bolesti (AD) dolazi do gubitka volumena sive mase u mezijalnim temporalnim i parijetalnim lobusima. Atrofija može da bude minimalna u ranim fazama bolesti, kao što je blago kognitivno oštećenje i preklinička AD, ali metabolički imidžing (FDG PET) obično pokazuje odstupanja (1, 14). ASL studije u već ustanovljenoj AD su konzistentno pokazale smanjenje cerebral blood flow (CBF) (5-8, 13, 15, 16) u posteriornom parijetalnom lobusu uključujući prekuneus, posteriorni cingulat, angularni girus i superiorni parijetalni girus (8). Šema hipoperfuzije koju pokazuje ASL odgovara šemi hipometabolizma na FDG PET-u (17) (Slika 1) i oba modaliteta imaju slične dijagnostičke mogućnosti (18). Slična šema hipoperfuzije se uočava i kod osoba sa blagim kognitivnim oštećenjem, a snižena perfuzija u prekuneusu može da predvidi prelazak u AD (19).
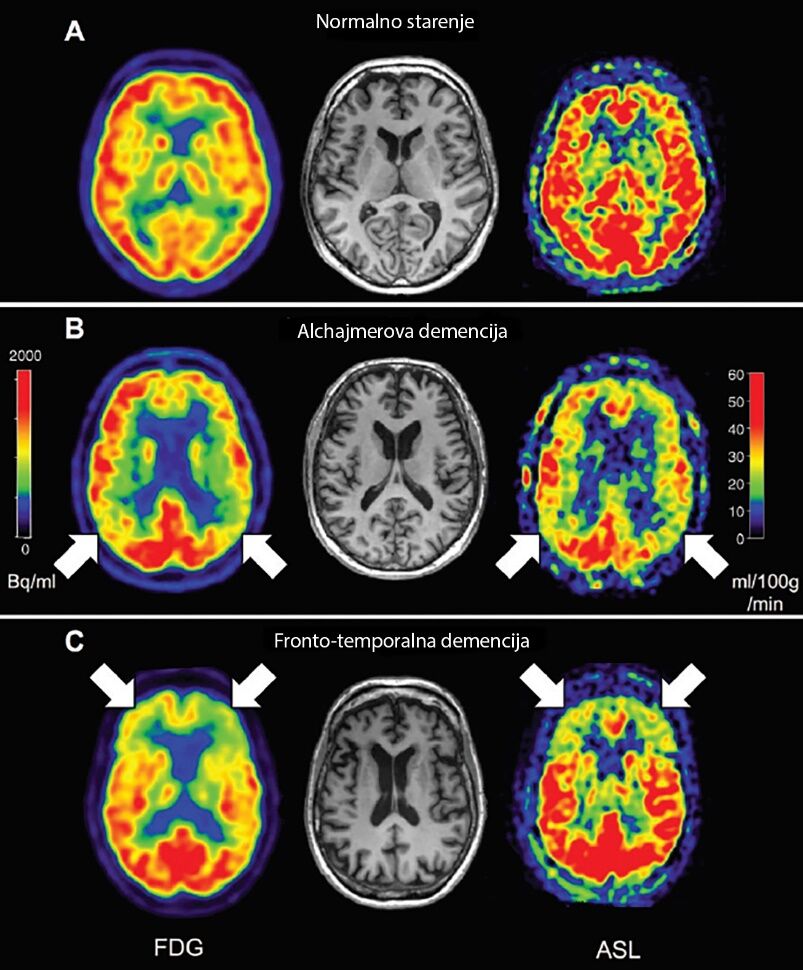
Slika 1: Primeri demencije. aksijalni FDG i ASL imidži: A zdrav dobrovoljac (muškarac, 57 godina; rezultat Mini-Mental testa [MMSE] 30), B pacijent sa AD (muškarac; 52 godine; MMSE 19), i, C pacijent sa frontotemporalnom lobarnom demencijom (žena; 53 godine; MMSE 26). Funkcionalni imidži (FDG i ASL) pokazuju odstupanja u prefrontalnom korteksu kod FTD i u parijetalnom korteksu kod AD. Zone crvene boje predstavljaju zone normalnog metabolizma i perfuzije. Fotografija preuzeta iz časopisa: Haller S, Zaharchuk G, Thomas DL, Lovblad KO, Barkhof F, Golay X. Arterial Spin Labeling Perfusion of the Brain: Emerging Clinical Applications. Radiology. 2016 Nov;281(2):337-356. Review.
Frontotemporalna lobarna demencija, Demencija Levijevih tela i Vaskularna demencija
Kod osoba sa Frontotemporalnom lobarnom demencijom je utvrđena desna frontalna hipoperfuzija, slično kao na FDG PET-u, dok je perfuzija u parijetalnim regijama i posteriornom cingularnom girusu očuvana u poređenju sa AD. Oba modaliteta: FDG i ASL pokazuju isti obrazac snižene perfuzije kod Frontotemporalne lobarne demencije koji se jasno razlikuje od AD (20). Kod Demencije sa Levijevim telima je registrovana posteriorna hipoperfuzija, u posterirnom cingularnom girusu i u asocijativnim vidnim zonama (21). Kod demencije koja nastaje kao posledica Parkinsonove bolesti se registruje posteriorna hipoperfuzija, koja se u većoj meri poklapa sa onom do koje dolazi kod AD, što govori o sličnim mehanizmima neurodegeneracije (22). Vaskularna demencija je po definiciji prouzrokovana smanjenom cerebralnom perfuzijom, u skladu sa tim snižen CBF se registruje u bilateralnim frontalnim i parijetalnim zonama kod osoba sa vaskularnom demencijom (23, 24) kao i kod osoba sa incidentalnim slivenim ishemijskim promenama bele mase (25). Moguće je da se parametri ASL dodatno optimizuju da bi se dobile pouzdane vrednosti CBF i u beloj masi (26-28), ali je obično signal u beloj masi nizak u odnosu na šum.
ASL u cerebrovaskularnim bolestima
Merenja perfuzije imaju široku primenu u cerebrovaskularnim bolestima i ishemijskim epizodama. Ova stanja se na ASL snimcima tipično manifestuju kao zone poremećene perfuzije ili odloženog arterijskog tranzitnog vremena, arterial transit time (ATT) jer nepravilno oblikovani, okludirani i oštećeni krvni sudovi perfunduju manje obeležene vode u poređenju sa normalnim krvnim sudovima (29). Primenom ASL perfuzije je moguća neinvazivna detekcija cerebrovaskularnih poremećaja, identifikovanje ishemijskih događaja i procena rizika.
Vaskularne bolesti
ASL može da identifikuje izmenjenu perfuziju mozga do koje dolazi usled stenoze ili konstrikcije krvnih sudova. Okluzija unutrašnje karotidne arterije ICA (30, 31) i stenoza (32) mogu da se detektuju pomoću ASL kao odloženo arterial transit time (ATT) u ipsilateralnoj hemisferi u odnosu na zahvaćeni krvni sud. Ovi rezultati su verifikovani poređenjem sa SPECT-om (33). Efekti hirurške korekcije postavljanjem stenta mogu da se kvantifikuju pomoću ASL (34). Kod bolesti Moja-moja (MMD), ASL može da utvrdi obim kolateralne perfuzije koja je jedan od pokazatelja težine bolesti i rizika za ishemiju. Rezultati merenja su u saglasnosti sa digitalnom suptrakcionom angiografijom (DSA) koja je zlatni standard (35). Uz urađen DSA, neinvazivna MRI metoda ASL može da obezbedi dopunske informacije na nivou tkiva o parenhimskoj rezervi (36). ASL merenja CBF kod MMD su u saglasnosti sa SPECT (37), kao i sa H2[15O]-PET kod mladih ispitanika (38). ASL perfuzija može da pomogne u ranom otkrivanju moždanog tkiva pod rizikom kod neurotuberkuloze (39) i Hašimoto encefalopatije (40). U okolini artrerijsko-venskog malformata (AVM) postoji zona hipoperfuzije zbog tzv. fenomena krađe koji može da se vidi upotrebom ASL (41). ASL je korisna metoda za praćenje efekata embolizacije (42), i stereotaktičke radiohirurgije AVM (43, 44). ASL može da prati status pacijenata pod rizikom za angiografski vazospazam u danima posle subarahnolidnog krvarenja (45). ASL je koristan i u praćenju hemodinamskih promena i mogućeg rizika od cerebralne hipoperfuzije posle revaskularizacije kod MMD (46, 47). Slično tome, kod osoba sa cirozom, posle plasiranja transjugularnog intrahepatičkog portosistemskog šanta kod ASL može da predvidi hepatičku encefalopatiju (48).
(Sub)akutna ishemija
ASL identifikuje ishemiju kao regiju izmenjene perfuzije usled anoksičnog oštećenja. ASL tehnika je primenjivana za merenje globalne hipoperfuzije kod osoba u stanjima minimalne svesti usled traume mozga, ishemije ili Hipoksično-ishemijske encefalopatije. Ponovljena ASL merenja u svim ovim stanjima mogu da daju korisne informacije u praćenju kliničkog poboljšanja (49). ASL se koristi i za identifikovanje zona sniženih vrednosti CBF kod osoba sa hroničnom ishemijskom bolesti. Ove zone sniženih CBF vrednosti često izgledaju potpuno uredno na snimcima konvencionalne magnetne rezonance. Njihovo identifikovanje može da pomogne u razumevanju promena ponašanja kod osoba sa hroničnom ishemijskom bolesti (50). ASL se takođe koristi za ispitivanje ishemijskih promena kod pacijenata sa Sindromom mitohondrijske encefalopatije, laktatne acidoze i epizoda sličnih moždanim udarima (MELAS), hiperperfuzija se pojavljuje u akutnoj fazi i hipoperfuzija u hroničnoj fazi (51).
Dijagnostikovanje tranzitornog ishemijskog ataka (TIA) nekad može da bude teško, a veoma je važno za optimalni ishod, jer odgovarajući tretman može da smanji rizik od ishemije za 80% (52). Kada postoji sumnja na TIA, obično se preporučuje difuzioni imidžing (DWI), ASL može dodatno da unapredi dijagnostičke mogućnosti MRI (53). Utvrđeno je da ASL ima veću senzitivnost za detektovanje promena do kojih dolazi usled TIA u poređenju sa DWI and MR angiografijom (54) i da je približno iste senzitivnosti kao DSC (perfuzija sa kontrastom). Kada se primeni unutar 24 h, ASL detektuje zone izmenjene perfuzije kod TIA koje nisu vidljive na konvencionalnim, morfološkim snimcima magnetne rezonance (55).
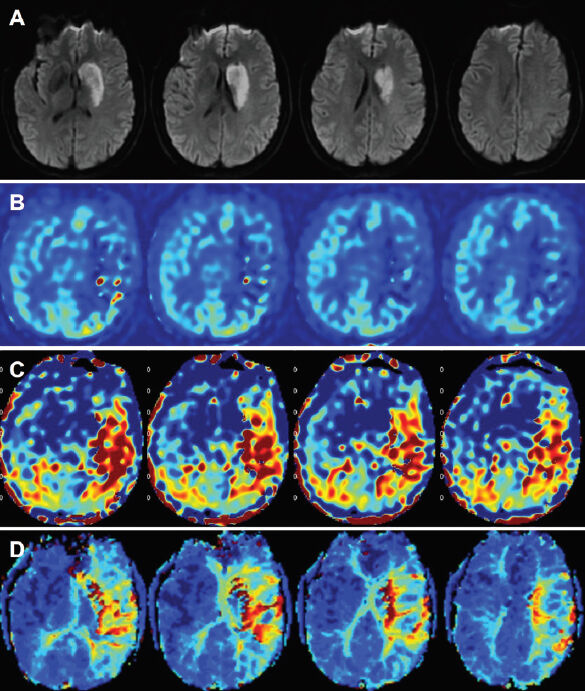
Slika 2. Imidži pedesetogodišnje žene sa ishemijom. U trenutku snimanja je prošlo 14 sati od razvoja desne hemipareze i afazije, tada je imala ocenu 9 prema skali za moždani udar Nacionalnog instituta za zdravlje (NIHSS skala). Kasnije je utvrđena ekstrakranijalna disekcija leve karotidne arterije. A, Difuzija (DWI) prikazuje ireverzibilno oštećeno tkivo u levom kaudatusu i putamenu. Slika B, prikazuje CBF a slika C, imidže tranzitnog arterijskog vremena dobijene ASL tehnikom na kojima je identifikovana veća regija poremećene perfuzije. Slika D, prikazuje perfuziju sa kontrastom (DSC) (time to the maximum). Rezultati ASL I DSC perfuzije su u saglasnosti. Fotografija preuzeta iz časopisa: Haller S, Zaharchuk G, Thomas DL, Lovblad KO, Barkhof F, Golay X. Arterial Spin Labeling Perfusion of the Brain: Emerging Clinical Applications. Radiology. 2016 Nov;281(2):337-356. Review.
Dokazano je da su za akutni ishemijski moždani udar, ASL tehnike ekvivalentne DSC tehnikama i da mogu da se koriste za tzv. mismatch pristup (identifikovanje penumbre) zajedno sa difuzionim imidžima (56, 57) (slika 2). Fokalna ishemija nastaje unutar perfuzionog područja arterije koja je stenozirana ili okludirana, gde je smrt neurona najizraženija u zoni ishemijskog jezgra (engl. core) to je ireverzibilno oštećenje. Zona penumbre predstavlja okolno tkivo koje je funkcionalno poremećeno, ali strukturno intaktno-reverzibilno oštećenje.
Primenom ASL se utvrđuje regionalna hipoperfuzija i na taj način se isključuju druge dijagnoze, što u nekim situacijama nije lako ili nije moguće ako se primenjuje samo konvencionalni, morfološki MRI. ASL regije sa sniženim CBF vrednostima posle ishemije su u saglasnosti sa regijama DSC hipoperfuzije (58). Prednost ASL je u boljem dijagnostikovanju graničnih i kortikalnih lezija (59).
ASL perfuzija je korisna u evaluaciji oštećenja i oporavka od arterijskog ishemijskog infarkta kod dece (60). Perinatalni i neonatalni ishemijski infarkti imaju relativno nejasne mehanizme i malo terapijskih opcija. Istraživanja su pokazala mogućnosti ASL u razjašnjavanju hemodinamike mozga, kao i izvodljivost kod tek rođenih beba i predlažu uključivanje ove metode u MRI protokole (61). Ustanovljene su i kvantitativne mere za procenu regionalne hiperperfuzije uz sniženu DWI posle neonatalnog ishemijskog oštećenja (62).
Hronična ishemija i cerebrovaskularna rezerva
ASL ima važnu ulogu u proceni rizika i posledica hroničnih cerebrovaskularnih bolesti. Može da se koristi za utvrđivanje cerebrovaskularne rezerve i sindroma hipoperfuzije.
Kapacitet cerebrovaskularne rezerve (CRC) opisuje koliko cerebralna perfuzija može da se poveća u kontekstu vazoaktivnih stimulusa kao što je inhalacija CO2 ili acetazolamid injekcija.
CRC se još uvek ne uzima u obzir prilikom postavljanja indikacija za hirurgiju karotidne arterije (63, 64), ali osobe sa stenozom karotidne arterije koje imaju nizak CRC imaju mnogo veći rizik da razviju infarkt mozga (65). Procena CRC može značajno da doprinese u proceni rizika pre hirurgije karotidne arterije i srca. ASL se kombinuje sa stimulusom acetazolamida da bi se ispitala cerebrovaskularna reaktivnost (66, 67), što omogućava identifikovanje tkiva koje je pod najvećim rizikom za pojavu ishemije (68). ASL se koristi i za praćenje efekata terapije. Na primer, studija koja poredi rezultate karotidne angioplastike sa implantacijom stenta sa rezultatima karotidne endarterektomije ilustruje oporavak kolateralnog protoka i normalizaciju regionalnog CBF (69). Lezije bele mase su jedan od znakova bolesti malih krvnih sudova, ali one se pojavljuju i kod neuroinflamacije, glioze i drugih procesa (70, 71). Još uvek nema dovoljno saznanja o tome da li kvantifikovanje perfuzije može da pomogne u razlikovanju različitih tipova lezija bele mase, ali pojedine studije ukazuju na korelaciju između poremećaja perfuzije i stepena oboljenja bele mase. Kod osoba sa težim stadijumom bolesti je utvrđen pad vrednosti CBF u beloj i u sivoj moždanoj masi (72).
ASL imidži su veoma osetljivi na promene ili fiziološke varijacije drenaže i cirkulacije u mozgu (normalne varijacije Vilisovog poligona i razvojne venske anomalije), i mogu se koristiti za detektovanje arterijsko-venskih malformata (AVM) ili fistula (AVF) (slika 3), kvantifikovanje arterio-venskog šanta, i ispitivanje promena CBF u neposrednom okruženju i u udaljenom moždanom tkivu (73). Ako se na ASL mapama utvrdi značajna asimetrija moždane perfuzije, važno je pregledati sve snimljene standardne MR sekvence i dodati MR angiografiju da bi se utvrdilo ili isključilo postojanje eventualnih varijacija ili patoloških vaskularnih šantova koji mogu da prouzrokuju odstupanja u perfuziji mozga.
Velike arterijsko-venske malformate i duralne arterijsko-venske fistule nije teško dijagnostikovati korišćenjem rutinskog anatomskog MR imidžinga, male lezije je teže identifikovati a složeno je i praćenje i evolucije lezija posle embolizacije. Dokazano je da se detektovanje malih lezija (< 2 cm) značajno unapređuje ako radiolog ima na raspolaganju i ASL kao dodatak rutinskom MRI (74). Venski signal se vidi u AVM na ASL imidžima, u slučaju intrakranijalne hemoragije i kada su inicijalni angiogrami negativni, verovatno zbog efekta mase.
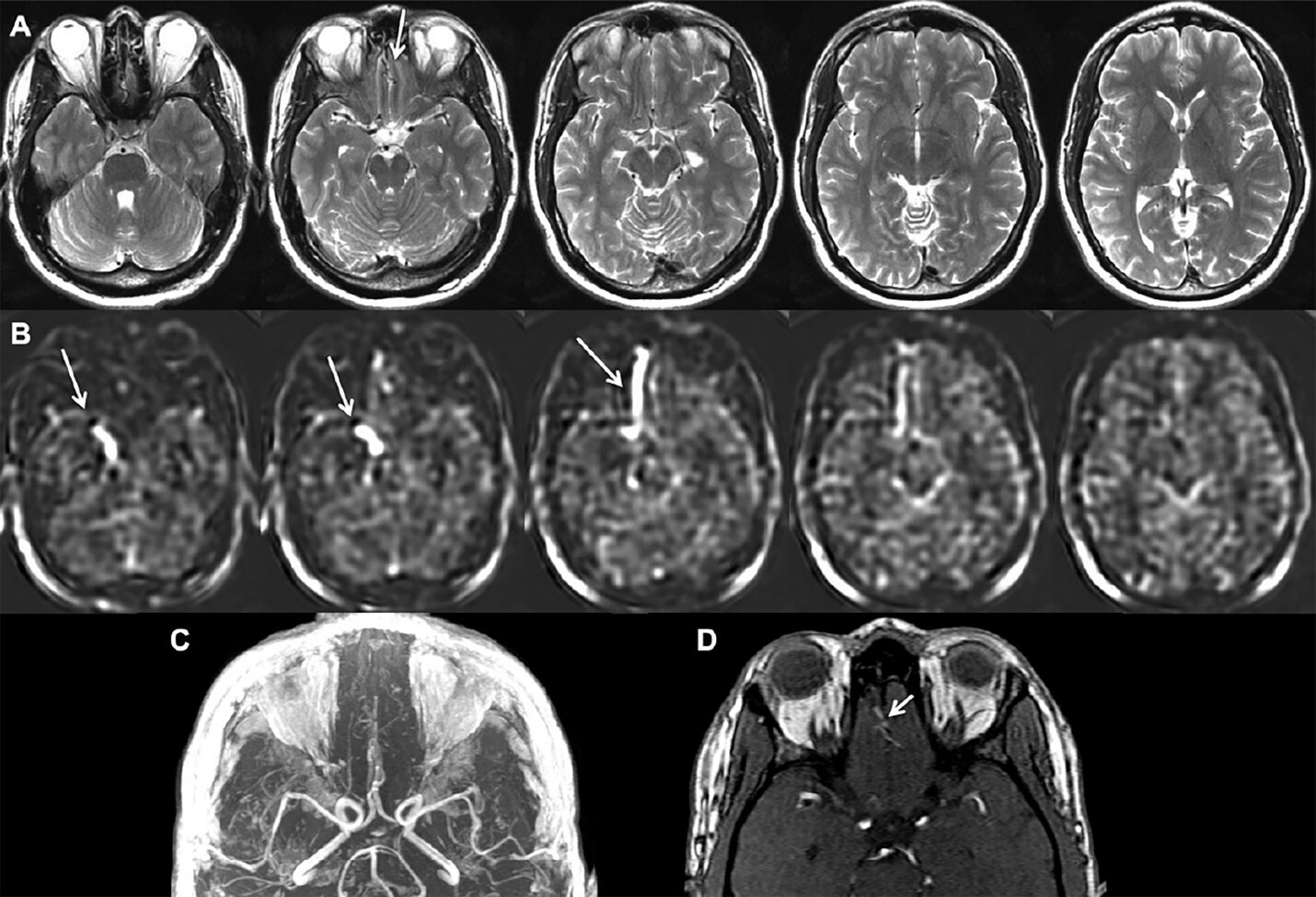
Slika 3:1.5T MRI muškarca starosti 51-godina sa glavoboljama i arterijsko-venskom fistulom. A, Na T2 imidžima se mogu videti veoma suptilni tzv. flow voids u inferiornom frontalnom lobusu (strelica). Termin flow void se odnosi na nizak signal u krvnim sudovima koji imaju snažan protok. B, ASL snimci prikazuju visok intenzitet signala (strelice) u desnom inferiornom frontalnom lobusu, koji se proteže do desnog kavernoznog sinusa, karakteristično za leziju u kojoj dolazi do arterijsko-venskog šanta. C, Multiplanarna rekonstrukcija angiografskih MR snimaka D, bazni MR angiografski imidži potvrđuju prisustvo etmoidne duralne fistule (strelica), koja je registrovana tek nakon pregledanja ASL snimaka i signala unutar venskih struktura koje dreniraju fistulu. Fotografija preuzeta iz časopisa: Haller S, Zaharchuk G, Thomas DL, Lovblad KO, Barkhof F, Golay X. Arterial Spin Labeling Perfusion of the Brain: Emerging Clinical Applications. Radiology. 2016 Nov;281(2):337-356. Review.
Neuro-onkologija
Kod većine neoplazija centralnog nervnog sistema dolazi do hemodinamskih promena, može se uopšteno reći da se CBF i cerebral blood volume (CBV) povećavaju sa gradusom tumora. Perfuzioni imidžing obezbeđuje korisne informacije o vaskularizaciji i vaskularnoj proliferaciji koje su direktno primenljive u proceni tumora mozga. Rast tumora zahteva značajno snabdevanje krvlju. Do angiogeneze dolazi kada neoplastičko tkivo dostigne kritičnu masu, funkcija i arhitektura novih krvnih sudova su u vezi sa tipom tumora (75). Relativni volumen moždane krvi tj. relative cerebral volume (CBV) je najčešće primenjivana mera perfuzije kod tumora mozga, meri se upotrebom perfuzije sa kontrastom tzv. DSC perfuzije. Veličina CBF merena upotrebom ASL perfuzije ima uporedivu vrednost u dijagnozi tumora, utvrđivanju gradusa, praćenju tumora i praćenju terapije.
Primarni tumori centralnog nervnog Sistema
Glioblastom multiforme je najčešći visokogradusni tumor kod odraslih, pokazuje visoke vrednosti CBF. Rezultati perfuzije sa kontrastom i ASL perfuzije su u saglasnosti za identifikovanje glioblastoma i za njihovo razlikovanje od drugih lezija koje se takođe boje posle primene kontrasta i po morfološkim odlikama izgledaju slično (76–79). Kod glioblastoma multiforme su vrednosti CBF visoke što je u skladu sa genetskim markerima (kao što je receptor epidermalnog faktora rasta) (80). Tumori nižeg gradusa demonstriraju niže vrednosti CBF. Porast CBF obično znači transformaciju u viši gradus. Posebno je važna primena perfuzije (ASL ili perfuzije sa kontrastom) kada nema porasta intenziteta signala u tumoru posle primene kontrasta. U takvim situacijama perfuzija može da otkrije zone u tumoru sa višim stepenom malignosti (slika 4).
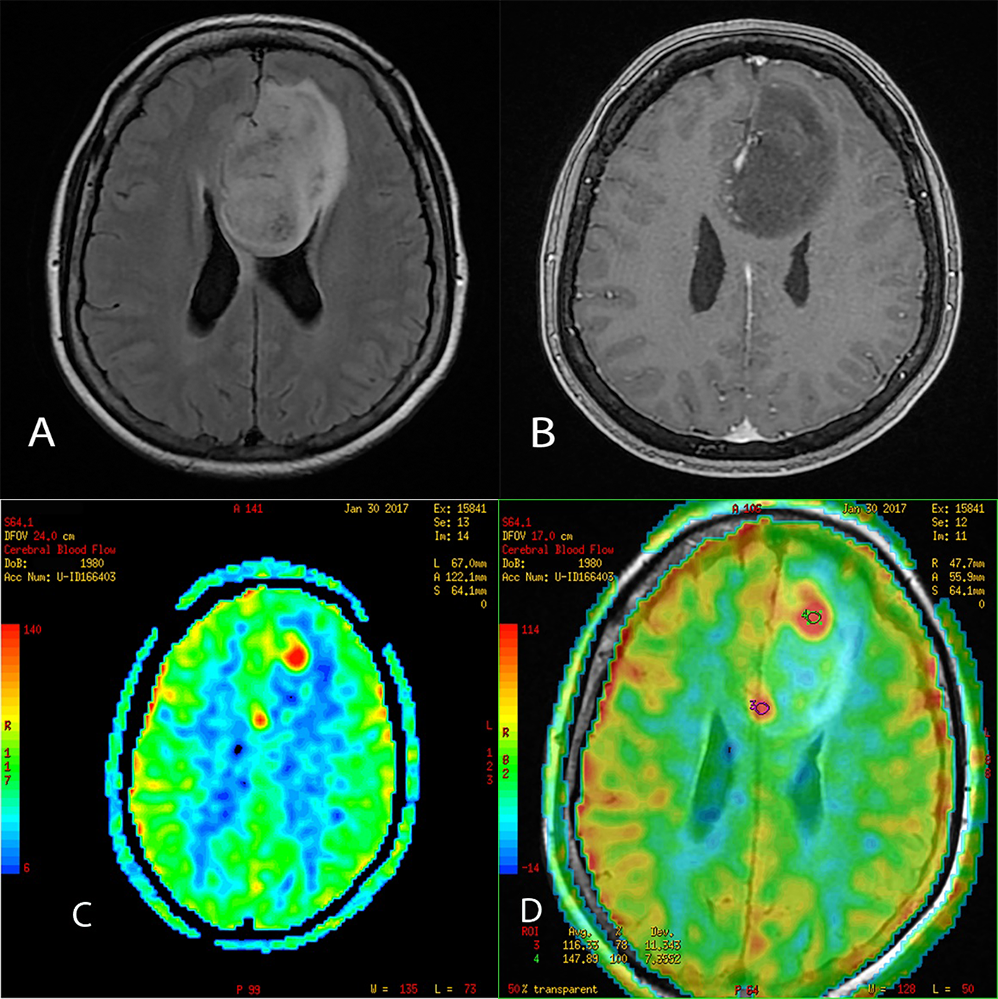
Slika 4. Na slikama A i B su FLAIR i post kontrastni T1 imidži glijalnog tumora. Na T1 nema značajnog porasta intenziteta signala posle primene kontrasta, ali slika C-ASL perfuzija pokazuje zone višeg gradusa u tumoru. Na slici D je data fuzija slika ASL perfuzije i FLAIR zbog boljeg uvida u prostorne odnose tj. na ovaj način možemo precizno da vidimo gde se nalaze zone dediferencijacije. Primer je iz mog kliničkog rada u Centru za radiologiju, Klinički Centar Vojvodine Novi Sad. Snimljeno na uređaju 1.5T.
Neki autori sugerišu da kvantifikacija CBF obezbeđuje bolju procenu preživljavanja bez recidiva za gliome nego histološko gradiranje (81). Izuzetak od ovog pravila po kom se na osnovu porasta CBF utvrđuje gradus glioma je oligodendrogliom kod kog tumor gradusa 2 često ima povišen CBF. ASL ima iste mogućnosti kao FDG PET i DWI u razlikovanju primarnih limfoma centralnog nervnog sistema (PCNSL) od glioblastoma, tako što identifikuje gušće i manje vaskularizovane limfome na osnovu niže perfuzije (82). Primer limfoma ilustruje strategiju za primenu ASL za razlikovanje tipova tumora: poređenje poznatih histoloških karakteristika sa brojnim vrednostima CBF da bi se dobile informacije bez invazivnog pristupa. Potvrđene su značajne razlike u ASL perfuziji između hemangioblastoma i glioma i između meningeoma i švanoma, zatim između hemangioblastoma i metastaza što je česta diferencijalna dijagnoza u zadnjoj lobanjskoj jami (83, 84). Dokazana je preciznost ASL u razlikovanju pilomiksoidnog astrocitoma (relativno novi dodatak WHO klasifikaciji) od pilocitičnog astrocitoma, što je važno za donošenje odluka o terapiji (85). ASL daje značajan doprinos razlikovanju tumora od drugih lezija. Na slici 5 je dat jedan takav primer, koji ilustruje prednosti metode ASL kao potpuno neinvazivne metode koja je jednostavno primenljiva i kod dece. Za konvencionalnu perfuziju sa kontrastom je neophodno korišćenje injektora i velike braunile.
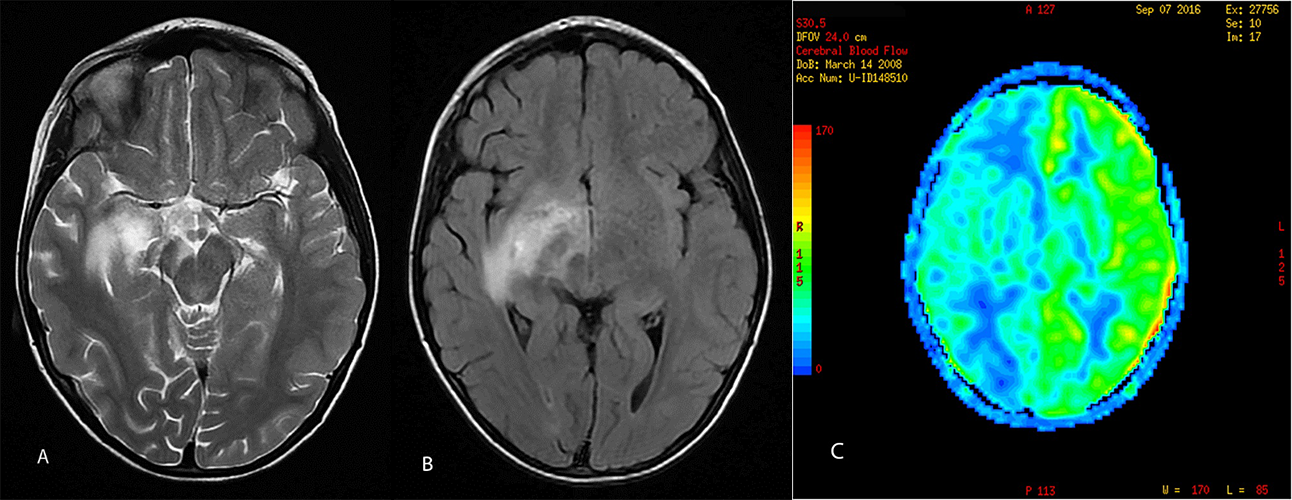
Slika 5. A, B Prikazuje T2 i FLAIR imidže devojčice uzrasta 8 godina koja je došla na MRI sa sumnjom na niskogradusni tumor mozga. Na slici C vdimo rezultat ASL perfuzije, hipoperfuzija u celoj desnoj hemisferi, odmah eliminiše dijagnozu tumora. Nije dokazano da li je priroda promene bila vaskularna ili inflamatorna, ali lezija se značajno smanjila i skoro potpuno nestala na trećem kontrolnom MRI. Primer je iz mog kliničkog rada u Centru za radiologiju, Klinički Centar Vojvodine Novi Sad. Snimljeno na uređaju 1.5T.
Sekundarni depoziti u centralnom nervnom sistemu
Kod većine metastaza u mozgu je metabolizam glukoze na PET-u sličan ili niži kao u sivoj masi, isto važi i za CBF. Pojedine metastaze, uključujući karcinom renalnih ćelija, angiosarkom, hemangioblastom i melanom imaju visoku vaskularizaciju i pokazuju porast CBF (84, 86). U ovim situacijama ASL perfuzija može da bude veoma korisna.
Praćenje terapijskog odgovora
Kvantitativna priroda ASL perfuzije omogućava praćenje promena tokom terapije i procene ishoda. Posebno je važno i u isto vreme složeno, napraviti razliku između radijacione nekroze i recidiva tumora kod pacijenata kod kojih se na post- terapijskom MRI pojavi novo kontrastno pojačanje. Recidiv visokogradusnog tumora najčešće ne može da se razlikuje od radijacione nekroze na konvencionalnoj magnetnoj rezonanci. Perfuzija daje značajan doprinos u razrešavanju ove česte dileme: Radijaciona nekroza ima snižen CBF, dok recidiv pokazuje porast CBF. DSC i MR spektroskopija se takođe uspešno koriste kod ove dileme (87–89). Produkti raspada krvi mogu da utiču na DSC, perfuziju sa kontrastom, zato ASL daje bolje rezultate u okolini šupljina nastalih posle resekcije. ASL je takođe manje osetljiv na prisustvo okolnih velikih krvnih sudova. Potvrđeno je da je ASL superioran ne samo u odnosu na DSC perfuziju, nego i u odnosu na FDG PET za razlikovanje recidiva tumora od radijacione nekroze sa senzitivnošću od 94% (90). ASL perfuzija se pokazala korisnijom od perfuzije sa kontrastom za period neposredno posle resekcije (< 4 nedelje) kada se smatra da je svako postkontrastno pojačanje verovatno posledica pseudoprogresije (91).
ASL u Epilepsiji
Uloga ASL perfuzije u kontekstu epilepsije je lociranje potencijalnog epileptogenog fokusa. Vrednosti CBF su povišene tokom akutnog peri-iktalnog perioda usled patološke aktivnosti neurona (92), a u hroničnom interiktalnom periodu su snižene jer je epileptogena zona manje funkcionalna i aktivna u poređenju sa normalnim moždanim tkivom (93-97). Tehnike nuklearne medicine kao što je iktalna i interiktalna tomografija pojedinačnim fotonom (SPECT) i PET se često primenjuju za detektovanje promena metabolizma usled epileptičke aktivnosti. ASL sekvenca može jednostavno da se doda rutinskom MRI protokolu za epilepsiju kao dodatni funkcionalni marker moždane perfuzije. To zahteva samo dodatnih 4-5 minuta tokom MR pregleda glave koji se kod epilepsije rutinski sprovodi. Hipoperfuzija na ASL imidžima odgovara hipoperfuziji na interiktalnom PET-u i podacima dobijenim elektrofiziološkim metodama (93, 94, 98), što ukazuje na potencijal ASL za lokalizaciju fokusa epilepsije.
ASL u psihijatrijskim i drugim neurološkim poremećajima
ASL se sve više primenjuje u ispitivanjima neurobioloških i anatomskih korelata psihijatrijskih stanja. Poremećena moždana mikrocirkulacija može da igra ulogu u nekim psihijatrijskim bolestima, iako mehanizmi još uvek nisu dovoljno poznati (99). Promene u regionalnim CBF vrednostima se pripisuju promenama u aktivnosti neurona i potrebi za energijom usled same bolesti ili terapije.
Depresija
U studiji u kojoj je učestvovalo 25 adolescenata sa kliničkom depresijom bez terapije je utvrđena značajna frontalna, limbička, paralimbička i cingularna hipoperfuzija (100). Autori su zaključili da se adolescenti sa depresijom razlikuju po vrednostima perfuzije u egzekutivnim, afektivnim i motornim mrežama. U više studija odraslih osoba sa depresijom je izmerena snižena perfuzija u osnovnoj neuronskoj mreži (default mode network) kao i u bilateralnom subgenualnom anteriornom cingularnom korteksu, levom prefrontalnom dorzomedijalnom korteksu i levim supkortikalnim zonama (putamen, palidum i amigdala) (101, 102). Izvršeno je i grupisanje pacijenata na one sa refraktornim i nerefraktornim depresivnim poremećajem (103). Osobe sa nerefraktornim depresivnim poremećajem u poređenju sa kontrolnom grupom su imale snižen CBF u levom prefrontalnom korteksu i povišen CBF u limbičko-strijatalnim zonama, dok su osobe sa refraktornim depresivnim poremećajem imale snižen CBF bilateralno frontalno i u talamusu. Kod depresije u kasnijim životnim dobima je utvrđen porast CBF u beloj masi, bez značajnih promena u sivoj masi (104).
Psihoze
Oboleli od šizofrenije su u poređenju sa kontrolnim ispitanicima imali povišene vrednosti CBF u levom putamenu/ koroni radijati superior i desnom srednjem temporalnom girusu, a snižene vrednsoti CBF u prekuneusu obostrano i srednjem frontalnom girusu (105). Podela pacijenata prema simptomima je ukazala na povezanost negativnih simptoma (uključujući teškoće u razmišljanju, smanjenom sposobnosti za iniciranje zadataka, niskim nivoom motivacije, smanjenim interesovanjem za druge ljude) sa sniženim CBF u bilateralnom superiornom temporalnom girusu, cingularnom girusu i levom srednjem frontalnom girusu i povezanost pozitivnih simptoma (deluzije, halucinacije, neorganizovan govor i ponašanje) sa povišenim CBF u cingularnom girusu i superiornom frontalnom girusu i sniženim CBF u precentralnom girusu/srednjem frontalnom girusu. Kod osoba sa graničnim poremećajem ličnosti je CBF snižen u medijalnom orbitofrontalnom korteksu i povišen u lateralnom orbitofrontalnom korteksu u poređenju sa zdravim dobrovoljcima (106). ASL može da se koristi za praćenje terapije. Dokazano je da merenja vrednosti CBFmogu da predvide odgovor na terapiju kod osoba sa depresijom (107) i šizofrenijom (108) što može da olakša individualizovanu terapiju.
Posttraumatski stresni poremećaj (PTSD)
U istraživanju koje je sprovedeno na veteranima sa PTSD (109) je registrovan porast CBF u desnom parijetalnom i superiornom temporalnom korteksu. Kada je primenjen složeniji dizajn studije kod veterana 20 godina posle Zalivskog rata, rađen je ASL sa primenom fizostigmina. Fizostigmin je doveo do smanjenja CBF u hipokampusu u kontrolnoj grupi ikod veterana sa sindromom 1 (kognitivni problemi), a značajno je povisio CBV u hipokampusu kod veterana sa sindromom 2 (konfuzija-ataksija) i 3 (centralni neuropatski bol) (110). ASL može da doprinese u razlikovanju podtipova PTSD.
Blaga traumatska povreda mozga
Postoji veliko interesovanje za blagu traumatsku povredu mozga (MTBI) zbog promena u mozgu do kojih dolazi kod profesionalnih fudbalera i drugih sportista. Konvencionalne MRI sekvence nisu dovoljno osetljive za detektovanje suptilnih strukturalnih promena, tako da se primenjuju nove imidžing tehnike kao što je ASL i difuzija (111). Kod osoba sa MTBI su registrovane snižene vrednosto CBF u talamusu obostrano (112). Kombinovanjem ASL sa difuzionim tenzorskim imidžingom i difuzionim kurtozis imidžingom su detektovana značajna odstupanja perfuzije u talamusu i integriteta bele mase kod osoba sa MTBI (113). Navedena odstupanja su bila prisutna 9 meseci posle povrede. Autori koji su istraživali akutnu fazu MTBI su pronašli povišene vrednosti CBF u levom strijatumu i u frontalnim i okcipitalnim lobusima (114). Kod dece sa MTBI je CBF snižen u frontotemporalnim regijama obostrano (115). ASL je senzitivna metoda za ispitivanje alteracija u mozgu u sklopu MTBI koje ne mogu da se detektuju konvencionalnim MRI tehnikama.
Bol i migrena
U ASL snimanjima zdravih dobrovoljaca tokom bolne termalne stimulacije su uočene obostrane promene CBF koje uključuju inzulu, sekundarni somatosenzorni i cingularni korteks kao i suplementarne motorne zone. Na taj način su kvantifikovane promene u perfuziji mozga prouzrokovane bolom (116). Drugi autori su sličnim pristupkom ustanovili promene CBF u somatosenzornom korteksu, anteriornom cingularnom korteksu, ateriornoj inzuli, hipokampusu, amigdali, talamusu i prekuneusu (117). Ove studije sugerišu da ASL može da se koristi kao marker subjektivnih bolnih sindroma. Kod pacijenata sa postterapijskom neuralgijom je uočena šema porasta CBF u levom strijatumu, desnom talamusu, levom primarnom somatosenzornom korteksu, levoj inzuli, levoj amigdali, levom primarnom somatomotornom korteksu i levom inferiornom parijetalnom lobusu, a pad CBF u frontalnom korteksu (118).
Migrena je od posebnog interesa za ASL imidžing. Smatra se da napadi migrene, uključuju vaskularnu disregulaciju. Mapiranje moždanog CBF pomoću ASL perfuzije može da obezbedi uvid u patofiziologiju migrene. Vršena su ASL snimanja tokom napada migrene i posle tretmana triptanom kao i u perodu bez napada (119). Tokom napada migrene, vrednosti CBF su bile snižene u srednjim talamičnim regijama uključujući hipotalamus, i povećane u frontalnom korteksu. Trideset minuta posle početka tretmana, CBF perfuzija se popravila u talamusu i hipotalamusu. Veća istraživanja su neophodna da bi se definisao doprinos ASL u objašnjenju patofiziologije bola, posebno vaskularne komponente migrene.
Literatura:
- Jack CR Jr, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, Petersen RC, Trojanowski JQ. Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. Lancet Neurol. 2010 Jan;9(1):119-28. doi: 10.1016/S1474-4422(09)70299-6.
- Brown RK, Bohnen NI, Wong KK, Minoshima S, Frey KA. Brain PET in suspected dementia: patterns of altered FDG metabolism. Radiographics. 2014 May-Jun;34(3):684-701. doi: 10.1148/rg.343135065.
- Buxton RB, Frank LR. A model for the coupling between cerebral blood flow and oxygen metabolism during neural stimulation. J Cereb Blood Flow Metab. 1997 Jan;17(1):64-72.
- Aubert A, Costalat R. A model of the coupling between brain electrical activity, metabolism, and hemodynamics: application to the interpretation of functional neuroimaging. Neuroimage. 2002 Nov;17(3):1162-81.
- Yoshiura T, Hiwatashi A, Noguchi T, et al. Arterial spin labelling at 3-T MR imaging for detection of individuals with Alzheimer’s disease. Eur Radiol 2009;19(12):2819–2825.
- Yoshiura T, Hiwatashi A, Yamashita K, et al. Simultaneous measurement of arterial transit time, arterial blood volume, and cerebral blood flow using arterial spin-la-beling in patients with Alzheimer disease. AJNR Am J Neuroradiol 2009;30(7):1388–1393.
- Dai W, Lopez OL, Carmichael OT, Becker JT, Kuller LH, Gach HM. Mild cognitive impairment and alzheimer disease: pat-terns of altered cerebral blood flow at MR imaging. Radiology 2009;250(3):856–866.
- Binnewijzend MA, Kuijer JP, Benedic-tus MR, et al. Cerebral blood flow measured with 3D pseudocontinuous arterial spin-labeling MR imaging in Alzheimer disease and mild cognitive impairment: a marker for disease severity. Radiology 2013;267(1):221–230.
- Wolk DA, Detre JA. Arterial spin labeling MRI: an emerging biomarker for Alzheimer’s disease and other neurode-generative conditions. Curr Opin Neurol 2012;25(4):421–428.
- Bozoki AC, Korolev IO, Davis NC, Hois-ington LA, Berger KL. Disruption of lim-bic white matter pathways in mild cogni-tive impairment and Alzheimer’s disease: a DTI/FDG-PET study. Hum Brain Mapp 2012;33(8):1792–1802.
- Pagani M, Dessi B, Morbelli S, et al. MCI patients declining and not-declining at midterm follow-up: FDG-PET findings. Curr Alzheimer Res 2010;7(4):287–294.
- Herholz K, Salmon E, Perani D, et al. Discrimination between Alzheimer dementia and controls by automated analysis of multicenter FDG PET. Neuroimage 2002; 17(1):302–316.
- Du AT, Jahng GH, Hayasaka S, et al. Hypoperfusion in frontotemporal dementia and Alzheimer disease by arterial spin labeling MRI. Neurology 2006;67(7):1215–1220.
- Jack CR Jr, Knopman DS, Jagust WJ, et al. Tracking pathophysiological processes in Alzheimer’s disease: an updated hypothetical model of dynamic biomarkers. Lancet Neurol 2013;12(2):207–216.
- Alsop DC, Detre JA, Grossman M. Assessment of cerebral blood flow in Alzheimer’s disease by spin-labeled magnetic resonance imaging. Ann Neurol 2000;47(1):93–100.
- Musiek ES, Chen Y, Korczykowski M, et al. Direct comparison of fluorodeoxyglucose positron emission tomography and arterial spin labeling magnetic resonance imaging in Alzheimer’s disease. Alzheimers Dement 2012;8(1):51–59.
- Chen Y, Wolk DA, Reddin JS, et al. Voxellevel comparison of arterial spin-labeled perfusion MRI and FDG-PET in Alzheimer disease. Neurology 2011;77(22):1977–1985
- Musiek ES, Chen Y, Korczykowski M, et al. Direct comparison of fluorodeoxyglucose positron emission tomography and arterial spin labeling magnetic resonance imaging in Alzheimer’s disease. Alzheimers Dement 2012;8(1):51–59.
- Chao LL, Buckley ST, Kornak J, et al. ASL perfusion MRI predicts cognitive decline and conversion from MCI to dementia. Alzheimer Dis Assoc Disord 2010;24(1):19–27
- Verfaillie SC, Adriaanse SM, Binnewijzend MA, et al. Cerebral perfusion and glucose metabolism in Alzheimer’s disease and frontotemporal dementia: two sides of the same coin? Eur Radiol 2015;25(10):3050–3059.
- Taylor JP, Firbank MJ, He J, et al. Visual cortex in dementia with Lewy bodies: magnetic resonance imaging study. Br J Psychiatry 2012;200(6):491–498.
- Le Heron CJ, Wright SL, Melzer TR, et al. Comparing cerebral perfusion in Alzheimer’s disease and Parkinson’s disease dementia: an ASL-MRI study. J Cereb Blood Flow Metab 2014;34(6):964–970.
- Schuff N, Matsumoto S, Kmiecik J, et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer’s disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement 2009;5(6):454–462.
- Gao YZ, Zhang JJ, Liu H, Wu GY, Xiong L, Shu M. Regional cerebral blood flow and cerebrovascular reactivity in Alzheimer’s disease and vascular dementia assessed by arterial spinlabeling magnetic resonance imaging. Curr Neurovasc Res 2013;10(1): 49–53.
- Bastos-Leite AJ, Kuijer JP, Rombouts SA, et al. Cerebral blood flow by using pulsed arterial spin-labeling in elderly subjects with white matter hyperintensities. AJNR Am J Neuroradiol 2008;29(7):1296–1301.
- van Gelderen P, de Zwart JA, Duyn JH. Pittfalls of MRI measurement of white matter perfusion based on arterial spin labeling. Magn Reson Med 2008;59(4):788–795.
- van Osch MJ, Teeuwisse WM, van Walderveen MA, Hendrikse J, Kies DA,van Buchem MA. Can arterial spin labeling detect white matter perfusion signal? Magn Reson Med 2009;62(1):165–173.
- Wu WC, Lin SC, Wang DJ, Chen KL, Li YD. Measurement of cerebral white matter perfusion using pseudocontinuous arterial spin labeling 3T magnetic resonance imaging: an experimental and theoretical investigation of feasibility. PLoS One 2013;8(12):e82679.
- Detre JA, Alsop DC, Vives LR, et al. Noninvasive MRI evaluation of cerebral blood flow in cerebrovascular disease. Neurology. 1998;50(3):633–641. doi: 10.1212/WNL.50.3.633.
- Hendrikse J, van Osch MJP, Rutgers DR et al (2004) Internal carotid artery occlusion assessed at pulsed arterial spin-labeling perfusion MR imaging at multiple delay times. Radiology 233(3):899–904
- Kimura H, Kado H, Koshimoto Y et al (2005) Multislice continuous arterial spin-labeled perfusion MRI in patients with chronic occlusive cerebrovascular disease: a correlative study with CO2 PET validation. J Magn Reson Imaging 22(2):189–198
- Bokkers RPH, van der Worp HB, Mali WPTM, Hendrikse J (2009) Noninvasive MR imaging of cerebral perfusion in patients with a carotid artery stenosis. Neurology 73(11):869–875
- Uchihashi Y, Hosoda K, Zimine I et al (2011) Clinical application of arterial spin-labeling MR imaging in patients with carotid stenosis: quantitative comparative study with single-photon emission CT. AJNR Am J Neuroradiol 32(8):1545–1551
- Yun TJ, Sohn C-H, Han MH et al (2013) Effect of carotid artery stenting on cerebral blood flow: evaluation of hemodynamic changes using arterial spin labeling. Neuroradiology 55(3):271–281
- Zaharchuk G, Do HM, Marks MP et al (2011) Arterial spin-labeling MRI can identify the presence and intensity of collateral perfusion in patients with moyamoya disease. Stroke 42(9):2485–2491
- Donahue MJ, Ayad M, Moore R et al (2013) Relationships between hypercarbic reactivity, cerebral blood flow, and arterial circulation times in patients with moyamoya disease. J Magn Reson Imaging 38(5):1129–1139
- Noguchi T, Kawashima M, Irie H et al (2011) Arterial spin-labeling MR imaging in moyamoya disease compared with SPECT imaging. Eur J Radiol 80(3):e557–e562
- Goetti R, Warnock G, Kuhn FP et al (2014) Quantitative cerebral perfusion imaging in children and young adults with moyamoya disease: comparison of arterial spin-labeling-MRI and H2[15O]-PET. AJNR Am J Neuroradiol 35(5):1022–1028
- Margariti P, Sanchez-Montanez A, Delgado I et al (2013) At-risk brain tissue identified with arterial spin labeling in neurotuberculosis. Pediatr Radiol 43(8):1049–1052
- Ishitobi M, Yoneda M, Ikawa M et al (2013) Hashimoto’s encephalopathy with hippocampus involvement detected on continuous arterial spin labeling. Psychiatry Clin Neurosci 67(2):128–129
- Fiehler J, Illies T, Piening M, et al. Territorial and microvascular perfusion impairment in brain arteriovenous malformations. AJNR Am J Neuroradiol. 2009;30(2):356–361. doi: 10.3174/ajnr.A1351.
- Suazo L, Foerster B, Fermin R, et al. Measurement of blood flow in arteriovenous malformations before and after embolization using arterial spin labeling. Interv Neuroradiol. 2012;18(1):42–48.
- Amponsah K, Ellis TL, Chan MD, et al. Retrospective analysis of imaging techniques for treatment planning and monitoring of obliteration for gamma knife treatment of cerebral arteriovenous malformation. Neurosurgery. 2012;71(4):893–899. doi: 10.1227/NEU.0b013e3182672a83.
- Shimizu K, Kosaka N, Yamamoto T, et al. (2014) Arterial spin labeling perfusion-weighted MRI for long-term follow-up of a cerebral arteriovenous malformation after stereotactic radiosurgery. Acta Radiol Short Rep 3(1)
- Aoyama K, Fushimi Y, Okada T, et al. Detection of symptomatic vasospasm after subarachnoid haemorrhage: initial findings from single time-point and serial measurements with arterial spin labelling. Eur Radiol. 2012;22(11):2382–2391. doi: 10.1007/s00330-012-2511-5.
- Saida T, Masumoto T, Nakai Y, et al. Moyamoya disease: evaluation of postoperative revascularization using multiphase selective arterial spin labeling MRI. J Comput Assist Tomogr. 2012;36(1):143–149. doi: 10.1097/RCT.0b013e31824150dd.
- Zhao WG, Luo Q, Jia JB, Yu JL. Cerebral hyperperfusion syndrome after revascularization surgery in patients with moyamoya disease. Br J Neurosurg. 2013;27(3):321–325. doi: 10.3109/02688697.2012.757294.
- Zheng G, Zhang LJ, Wang Z, et al. Changes in cerebral blood flow after transjugular intrahepatic portosystemic shunt can help predict the development of hepatic encephalopathy: an arterial spin labeling MR study. Eur J Radiol. 2012;81(12):3851–3856. doi: 10.1016/j.ejrad.2012.07.003.
- Liu AA, Voss HU, Dyke JP et al (2011) Arterial spin labeling and altered cerebral blood flow patterns in the minimally conscious state. Neurology 77(16):1518–1523
- Brumm KP, Perthen JE, Liu TTet al (2010) An arterial spin labeling investigation of cerebral blood flow deficits in chronic stroke survivors. Neuroimage 51(3):995–1005
- Wang Z, Xiao J, Xie S et al (2012) MR evaluation of cerebral oxygen metabolism and blood flow in stroke-like episodes of MELAS. J Neurol Sci 323(1–2):173–177
- Rothwell PM, Giles MF, Chandratheva A et al (2007) Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population based sequential comparison. Lancet 370(9596):1432–1442
- Kleinman JT, Zaharchuk G, Mlynash M et al (2012) Automated perfusion imaging for the evaluation of transient ischemic attack. Stroke 43(6):1556–1560
- Zaharchuk G, Olivot J-M, Fischbein NJ et al (2012) Arterial spin labeling imaging findings in transient ischemic attack patients: comparison with diffusion- and bolus perfusion-weighted imaging. Cerebrovasc Dis 34(3):221–228
- Qiao XJ, Salamon N, Wang DJJ et al (2013) Perfusion deficits detected by arterial spin-labeling in patients with TIA with negative diffusion and vascular imaging. AJNR Am J Neuroradiol 34(11):2125–2130
- Zaharchuk G, El Mogy IS, Fischbein NJ, Albers GW. Comparison of arterial spin labelingand bolus perfusion-weighted imaging for detecting mismatch in acute stroke. Stroke 2012;43(7):1843–1848.
- Bivard A, Krishnamurthy V, Stanwell P, et al. Arterial spin labeling versus bolustracking perfusion in hyperacute stroke.Stroke 2014;45(1):127–133.
- Wang DJJ, Alger JR, Qiao JX et al (2012) The value of arterial spin-labeled perfusion imaging in acute ischemic stroke: comparison with dynamic susceptibility contrast-enhanced MRI. Stroke 43(4):1018–1024
- Hendrikse J, Petersen ET, Chèze A et al (2009) Relation between cerebral perfusion territories and location of cerebral infarcts. Stroke 40(5):1617–1622
- Chen J, Licht DJ, Smith SE et al (2009) Arterial spin labeling perfusion MRI in pediatric arterial ischemic stroke: initial experiences. J Magn Reson Imaging 29(2):282–290
- Wintermark P,Warfield SK (2012) New insights in perinatal arterial ischemic stroke by assessing brain perfusion. Trans Stroke Res 3(2):255–262
- Pienaar R, PaldinoMJ,Madan N et al (2012) A quantitative method for correlating observations of decreased apparent diffusion coefficient with elevated cerebral blood perfusion in newborns presenting cerebral ischemic insults. Neuroimage 63(3):1510–1518
- Njemanze PC, Beck OJ, Gomez CR et al (1991) North American symptomatic carotid endarterectomy trial. Methods, patient characteristics, and progress. Stroke 22(6):711–720
- European Carotid Surgery Trialists’ Collaborative Group (1998) Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet 351(9113):1379–1387
- Stoll M, Hamann GF (2002) Cerebrovascular reserve capacity. Nervenarzt 73(8):711–718
- Detre JA, Samuels OB, Alsop DC et al (1999) Noninvasive magnetic resonance imaging evaluation of cerebral blood flow with acetazolamide challenge in patients with cerebrovascular stenosis. J Magn Reson Imaging 10(5):870–875
- Kamano H, Yoshiura T, Hiwatashi A et al (2013) Arterial spin labeling in patients with chronic cerebral artery steno-occlusive disease: correlation with 15O-PET. Acta Radiol 54(1):99–106
- Bokkers RPH, Osch MJPV, Klijn CJM et al (2011) Cerebrovascular reactivity within perfusion territories in patients with an internal carotid artery occlusion. J Neurol, Neurosurg Psychiatry 82(9):1011–1016
- Van Laar PJ, Hendrikse J, Mali WPTM et al (2007) Altered flow territories after carotid stenting and carotid endarterectomy. J Vasc Surg 45(6):1155–1161
- Hesselink JR (2006) Differential diagnostic approach to MR imaging of white matter diseases. Top Magn Reson Imaging 17(4): 243–263
- Zhang Q, Stafford RB, Wang Z et al (2012) Microvascular perfusion based on arterial spin labeled perfusion MRI as a measure of vascular risk in Alzheimer’s disease. J Alzheimers Dis 32(3):677–687
- Bastos-Leite AJ, Kuijer JPA, Rombouts SARB et al (2008) Cerebral blood flow by using pulsed arterial spin-labeling in elderly subjects with white matter hyperintensities. AJNR Am J Neuroradiol 29(7):1296–1301
- Wolf RL, Wang J, Detre JA et al (2008) Arteriovenous shunt visualization in arteriovenous malformations with arterial spinlabeling MR imaging. AJNR Am J Neuroradiol 29(4):681–687
- Le TT, Fischbein NJ, André JB, Wijman C, Rosenberg J, Zaharchuk G. Identification of venous signal on arterial spin labeling improves diagnosis of dural arteriovenous fistulas and small arteriovenous malformations. AJNR Am J Neuroradiol 2012;33(1):61–68.
- Lüdemann L, Warmuth C, Plotkin M et al (2009) Brain tumor perfusion: comparison of dynamic contrast enhanced magnetic resonance imaging using T1, T2, and T2* contrast, pulsed arterial spin labeling, and H2(15)O positron emission tomography. Eur J Radiol 70(3):465–474
- Warmuth C, Gunther M, Zimmer C. Quantification of blood flow in brain tumors: comparison of arterial spin labeling and dynamic susceptibility-weighted contrast-enhanced MR imaging. Radiology 2003;228(2):523–532.
- Wolf RL, Wang J, Wang S, et al. Grading of CNS neoplasms using continuous arterial spin labeled perfusion MR imaging at 3 Tesla. J Magn Reson Imaging 2005; 22(4):475–482.
- Järnum H, Steffensen EG, Knutsson L, et al. Perfusion MRI of brain tumours: a comparative study of pseudo-continuous arterial spin labelling and dynamic susceptibility contrast imaging. Neuroradiology 2010;52(4):307–317.
- Lehmann P, Monet P, de Marco G, et al. A comparative study of perfusion measurement in brain tumours at 3 Tesla MR: arterial spin labeling versus dynamic susceptibility contrast-enhanced MRI. Eur Neurol 2010;64(1):21–26.
- Qiao XJ, Ellingson BM, Kim HJ, et al. Arterial spin-labeling perfusion MRI stratifies progression-free survival and correlates with epidermal growth factor receptor status in glioblastoma. AJNR Am J Neuroradiol 2015;36(4):672–677.
- Furtner J, Bender B, Braun C, et al. Prognostic value of blood flow measurements using arterial spin labeling in gliomas. PLoS One 2014;9(6):e99616.
- Yamashita K, Yoshiura T, Hiwatashi A et al (2013) Differentiating primary CNS lymphoma from glioblastoma multiforme: assessment using arterial spin labeling, diffusion-weighted imaging, and (18)f-fluorodeoxyglucose positron emission tomography. Neuroradiology 55(2):135–143
- Noguchi T, Yoshiura T, Hiwatashi A et al (2008) Perfusion imaging of brain tumors using arterial spin-labeling: correlation with histopathologic vascular density. AJNR Am J Neuroradiol 29(4):688–693
- Yamashita K, Yoshiura T, Hiwatashi A et al (2012) Arterial spin labeling of hemangioblastoma: differentiation from metastatic brain tumors based on quantitative blood flow measurement. Neuroradiology 54(8):809–813
- Nabavizadeh SA, Assadsangabi R, Hajmomenian M et al (2015) High accuracy of arterial spin labeling perfusion imaging in differentiation of pilomyxoid from pilocytic astrocytoma. Neuroradiology 57(5):527–533
- De Bazelaire C, Rofsky NM, Duhamel G, Michaelson MD, George D, Alsop DC. Arterial spin labeling blood flow magnetic resonance imaging for the characterization of metastatic renal cell carcinoma(1). Acad Radiol 2005;12(3):347–357.
- Sugahara T, Korogi Y, Tomiguchi S, et al. Posttherapeutic intraaxial brain tumor: the value of perfusion-sensitive contrast-enhanced MR imaging for differentiating tumor recurrence from nonneoplastic contrastenhancing tissue. AJNR Am J Neuroradiol 2000;21(5):901–909.
- Henry RG, Vigneron DB, Fischbein NJ, et al. Comparison of relative cerebral blood volume and proton spectroscopy in patients with treated gliomas. AJNR Am J Neuroradiol 2000;21(2):357–366.
- Barajas RF Jr, Chang JS, Segal MR, et al. Differentiation of recurrent glioblastoma multiforme from radiation necrosis after external beam radiation therapy with dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. Radiology 2009;253(2):486–496.
- Ozsunar Y, Mullins ME, Kwong K, et al. Glioma recurrence versus radiation necrosis? a pilot comparison of arterial spinsequences labeled, dynamic susceptibility contrast enhanced MRI, and FDG-PET imaging. Acad Radiol 2010;17(3):282–290.
- Choi YJ, Kim HS, Jahng GH, Kim SJ, Suh DC. Pseudoprogression in patients with glioblastoma: added value of arterial spin labeling to dynamic susceptibility contrast perfusion MR imaging. Acta Radiol 2013;54(4):448–454.
- Nguyen D, Kapina V, Seeck M, Viallon M, Fedespiel A, Lovblad KO. Ictal hyperperfusion demonstrated by arterial spin-labeling MRI in status epilepticus. J Neuroradiol 2010;37(4):250–251.
- Pendse N, Wissmeyer M, Altrichter S, et al. Interictal arterial spin-labeling MRI perfusion in intractable epilepsy. J Neuroradiol 2010;37(1):60–63.
- Lim YM, Cho YW, Shamim S, et al. Usefulness of pulsed arterial spin labeling MR imaging in mesial temporal lobe epilepsy. Epilepsy Res 2008;82(2-3):183–189.
- Storti SF, Boscolo Galazzo I, Del Felice A, et al. Combining ESI, ASL and PET for quantitative assessment of drug-resistant focal epilepsy. Neuroimage 2014;102(Pt 1): 49–59.
- Miyaji Y, Yokoyama M, Kawabata Y, et al. Arterial spin-labeling magnetic resonance imaging for diagnosis of late seizure after stroke. J Neurol Sci 2014;339(1-2):87–90.
- Toledo M, Munuera J, Salas-Puig X, Santamarina E, Lacuey N, Rovira A. Localisation value of ictal arterial spin-labelled sequences in partial seizures. Epileptic Disord 2011;13(3):336–339.
- Blauwblomme T, Boddaert N, Chémaly N, et al. Arterial Spin Labeling MRI: a step forward in non-invasive delineation of focal cortical dysplasia in children. Epilepsy Res 2014;108(10):1932–1939.
- Théberge J (2008) Perfusion magnetic resonance imaging in psychiatry. Top Magn Reson Imaging 19(2):111–130
- Ho TC, Wu J, Shin DD, et al. Altered cerebral perfusion in executive, affective, and motor networks during adolescent depression. J Am Acad Child Adolesc Psychiatry 2013;52(10):1076–1091.e2.
- Orosz A, Jann K, Federspiel A, et al. Reduced cerebral blood flow within the default-mode network and within total gray matter in major depression. Brain Connect 2012;2(6):303–310.
- Duhameau B, Ferré JC, Jannin P, et al. Chronic and treatment-resistantdepression: a study using arterial spin labeling perfusion MRI at 3Tesla. Psychiatry Res 2010;182(2):111–116.
- Lui S, Parkes LM, Huang X, et al. Depressive disorders: focally altered cerebral perfusion measured with arterial spin-labeling MR imaging. Radiology 2009;251(2):476–484.
- Colloby SJ, Firbank MJ, He J, et al. Regional cerebral blood flow in late-life depression: arterial spin labelling magnetic resonance study. Br J Psychiatry 2012;200(2):150–155.
- Pinkham A, Loughead J, Ruparel K, et al. Resting quantitative cerebral blood flow in schizophrenia measured by pulsed arterial spin labeling perfusion MRI. Psychiatry Res 2011;194(1):64–72.
- Wolf RC, Thomann PA, Sambataro F et al (2012) Orbitofrontal cortex and impulsivity in borderline personality disorder: an MRI study of baseline brain perfusion. Eur Arch Psychiatry Clin Neurosci 262(8):677–685
- Weiduschat N, Dubin MJ (2013) Prefrontal cortical blood flow predicts response of depression to RTMS. J Affect Disord 150(2):699–702
- Homan P, Kindler J, Hauf M et al (2012) Cerebral blood flow identifies responders to transcranial magnetic stimulation in auditory verbal hallucinations. Transl Psychiatry 2, e189
- Schuff N, Zhang Y, Zhan W, et al. Patterns of altered cortical perfusion and diminished subcortical integrity in posttraumatic stress disorder: an MRI study. Neuroimage 2011;54(Suppl 1):S62–S68.
- Li X, Spence JS, Buhner DM, et al. Hippocampal dysfunction in Gulf War veterans: investigation with ASL perfusion MR imaging and physostigmine challenge. Radiology 2011;261(1):218–225.
- Grossman EJ, Jensen JH, Babb JS, et al. Cognitive impairment in mild traumatic brain injury: a longitudinal diffusional kurtosis and perfusion imaging study. AJNR Am J Neuroradiol 2013;34(5):951–957, S1–S3.
- Ge Y, Patel MB, Chen Q, et al. Assessment of thalamic perfusion in patients with mild traumatic brain injury by true FISP arterial spin labelling MR imaging at 3T. Brain Inj 2009;23(7):666–674.
- Grossman EJ, Jensen JH, Babb JS, et al. Cognitive impairment in mild traumatic brain injury: a longitudinal diffusional kurtosis and perfusion imaging study. AJNR Am J Neuroradiol 2013;34(5):951–957, S1–S3.
- Doshi H, Wiseman N, Liu J, et al. Cerebral hemodynamic changes of mild traumatic brain injury at the acute stage. PLoS One 2015;10(2):e0118061. [Published corrections appear in PLoS One 2015;10(5):e0127487 and PLoS One 2015;10(7):e0132750.]
- Wang Y, West JD, Bailey JN, et al. Decreased cerebral blood flow in chronic pediatric mild TBI: an MRI perfusion study. Dev Neuropsychol 2015;40(1):40–44.
- Owen DG, Bureau Y, Thomas AW, Prato FS, St Lawrence KS. Quantification of pain-induced changes in cerebral blood flow by perfusion MRI. Pain 2008;136(1-2):85–96.
- Maleki N, Brawn J, Barmettler G, Borsook D, Becerra l. Pain response measured with arterial spin labeling. NMR Biomed 2013;26(6)664–673.
- Liu J, Hao Y, Du M, et al. Quantitative cerebral blood flow mapping and functional connectivity of postherpetic neuralgia pain: a perfusion fMRI study. Pain 2013;154(1):110–118.
- Kato Y, Araki N, Matsuda H, Ito Y, Suzuki C. Arterial spin-labeled MRI study of migraine attacks treated with rizatriptan. J Headache Pain 2010;11(3):255–258.