Difuzioni tenzorski imidžing u kliničkom radu
vanredni profesor dr sc. Jelena Ostojić medicinski fizičar specijalista
Difuzioni tenzorski imidžing (DTI) je neinvazivna metoda magnetne rezonance koja se koristi za ispitivanje strukture bele moždane mase. Razlike u DTI signalima tj. kontrast generiše različito Braunovo kretanje molekula vode u tkivu. Obrađene skalarne vrednosti DTI mogu da se koriste za analizu promena nastalih u tkivu mozga zbog nastanka i napredovanja bolesti, i odgovora na terapiju, što je dovelo do ogromnog interesovanja za ovu metodu u kliničkom radu i kliničkim istraživanjima. Merenje pokretljivosti molekula vode u tkivu koje se vrši u DTI tehnici omogućava ispitivanje mikrostrukturnih promena u mozgu. Napredak rezolucije DTI je omogućio detektovanje mikrostrukturalnih promena u aksonima i mijelinu bele mase koje su specifične za određenu patologiju (2). Glavni fokus DTI je praćenje (tracking) puteva neurona u centralnom nervnom sistemu (3). Uspostavljena je primena ove metode u kliničkoj praksi: rutinski se koristi kod akutnog ishemijskog infarkta za razlikovanje vazogenog od citotoksičnog edema i za karakterizaciju intrakranijalnih lezija kao što je piogeni absces, infekcije, tumori i trauma (4). U velikoj meri se koristi i u prekliničkim istraživanjima. U kliničkom radu se DTI trenutno najviše primenjuje za lociranje važnih motornih i ostalih funkcionalnih puteva u sklopu planiranja neurohirurških i radioterapijskih procedura. DTI se koristi i izvan mozga, za analizu drugih tkiva uključujući kičmenu moždinu (5,6), perfierne nerve (7,8), miokard (9), dojku (10,11), mišiće (8,12), bubrege (13,14), prostatu (15,16), i uterus (17), i može da pomogne u analizi poremećaja ovih organa.
Uloga DTI u planiranju neurohirurških procedura
Pored informacija o lokalnom ćelijskom okruženju i organizaciji , DTI pruža informacije o putevima bele mase i vezama između važnih kortikalnih i supkortikalnih funkcionalnih zona u mozgu. Mikrostrukturalni elementi uključujući celularnost, organizaciju aksona, gustinu vlakana, mijelinaciju i prečnik vlakana se kombinuju sa makroskopskom organizacijom puteva i utiču na difuzionu anizotropiju koja je u osnovi DTI mape frakcione anizotropije (FA) u boji. Mapa FA (dobijamo je obradom snimljenih DTI podataka) obezbeđuje tro-dimenzionalne slike koje prikazuju pravac i nivo anizotropije (usmerenosti), dok traktografija puteva (engl. fiber tractography, FT) prikazuje veze jednog dela mozga sa drugim. Postoji mnogo dokaza koji ukazuju na važnost primene DTI pre hirurgije ne samo za pravljenje plana za hirurški pristup nego i u pogledu utvrđivanja bezbednosti, terapije posle operacije i ishoda. Primarni cilj preoperativnog DTI je procena izvodljivosti resekcije i procena maksimalnih- mogućih tj. bezbednih margina resekcije uz maksimalno moguće izbegavanje povrede funkcionalno važnih kortikalnih i supkortikalnih zona (dobijaju se primenom funkcionalnog MRI) i važnih puteva u beloj masi (DTI). Mape aktivacije koje se dobijaju funkcionalnim MRI mogu da se prikažu zajedno sa DTI mapama i inkorporiraju sa tro-dimenzionalnim snimcima anatomije. Tako dobijamo prostorne odnose lezije i funkcionalno aktivnih zona.To posebno važno kada efekat mase dovede do distorzije kortikalnih i supkortikalnih struktura tako da ne možemo da koristimo standardni raspored funkcije i puteva (18,19). U nekim situacijama DTI može da obezbedi dovoljno informacija za lokalizovanje funkcionalnog korteksa umesto funkcionalnog MRI (20) (Slike 1. i 2.). Anatomija puteva supkortikalne bele mase je veoma kompleksna, ali postoje tri glavne kategorije: asocijativni, projekcioni i komisuralni.
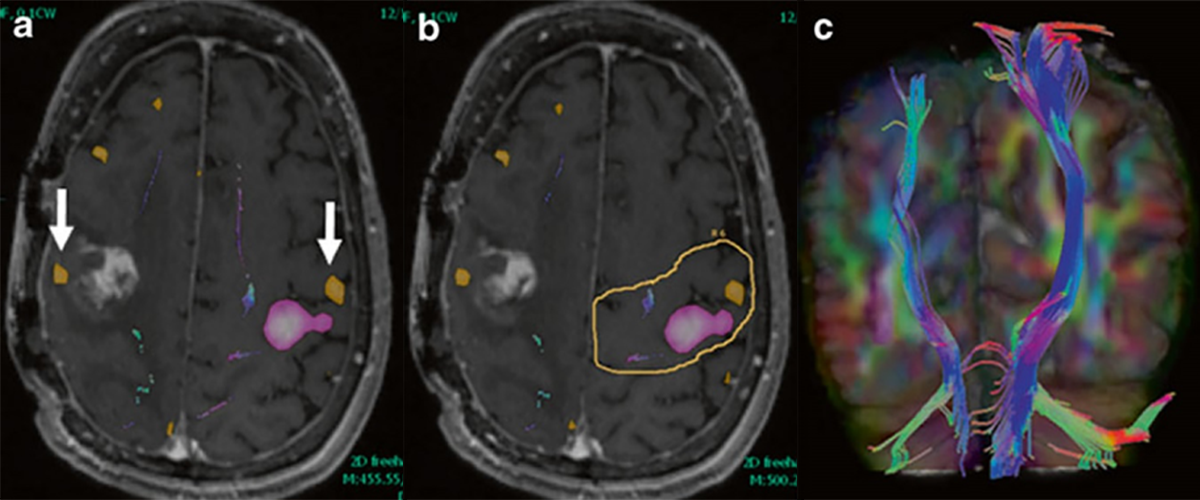
Slika 1. Mapiranje kortikospinalnog puta (KSP) vođeno funkcionalnim imidžingom (fMRI). ROI postavljen u cerebralnom pedunklu pokazuje vlakna cerebrospinalnog puta. Na mapama aktivacije ( a i b , postkontrastni T1 imidži) se vidi zona funkcije ruke ( roze boja ) i lica ( narandžasta ), mape aktivacije su korišćene za odabir ROI oko senzorimotornog korteksa. Slika je preuzeta iz reference 4.
Slika 2. Kortikospinalni put i superiorni longitudinalni fascikulus kod pacijenta sa oboljenjem gliomatozis cerebri. Levi kortikospinalni put (slike a i b) i superiorni longitudinalni fascikulus (slike c, d) su prikazani na FLAIR (a, c) i 3D imidžima (b, d). Slika je preuzeta iz reference 4.
Motorne funkcije
Mapiranje kortikospinalnog (piramidnog) trakta (KSP) i motornog korteksa se vrši da ne bi došlo do oštećenja motornih funkcija prilikom operacije. Postoje brojni dokazi da su ove tehnike veoma korisne za preoperativno planiranje (18, 21-25). Osnovna DTI traktografija piramidnog puta daje dobre rezultate za torzo, ruke i donje ekstremitete, ako patologija nije značajno oštetila trakt. Primenom multitenzor pristupa je moguće mapiranje i drugih kortikalnih regija uključujući lice i jezik. Mnoge studije su pokazale pozitivan uticaj DTI na hirurški plan i ishod (21,26,27-31), sa očuvanim ili unapređenim motornim funkcijama posle operacije. Potvrđena je visoka korelacija DTI traktografije za kortikospinalni put i više jezičkih puteva (27) sa intraoperativnim supkortikalnim mapiranjem. Kod niskogradusnih glioma se često utvrđuju putevi koji prolaze kroz tumor. Kombinovanje informacija koje obezbeđuje DTI traktografija i intraoperativnog supkortikalnog mapiranja smanjuje dužinu trajanja operacije i broj intraoperativnih epileptičkih napada. Postoperativni deficit se kratkotrajno poveća posle operacije, sa povećanjem obima resekcije što se unapređuje tokom vremena (32,33). Uveden je koncept bezbedne margine od 5-10 mm, što može da se minimizira sa pažljivim preoperativnim DTI mapiranjem (32). U studiji koja je sprovedena na 214 dokazanih glioma u blizini piramidnog puta izvršeno je poređenje rezultata operacije kada je primenjena samo neuronavigacija i kada su u sistem za neuronavigaciju dodati DTI podaci. Kod osoba kod kojih je urađen i DTI je u većem procentu mogla da se sprovede kompletna resekcija visokogradusnog tumora 74.4% u odnosu na 33.3% bez DTI. Do pogoršanja motornih funkcija posle operacije je došlo kod manjeg broja onih kod kojih je urađen i DTI. Unapređeno je i preživljavanje za visokogradusne gliome (32). Slike 3 i 4 ilustruju utvrđivanje položaja piramidnog puta u odnosu na leziju u sklopu planiranja hirurgije.
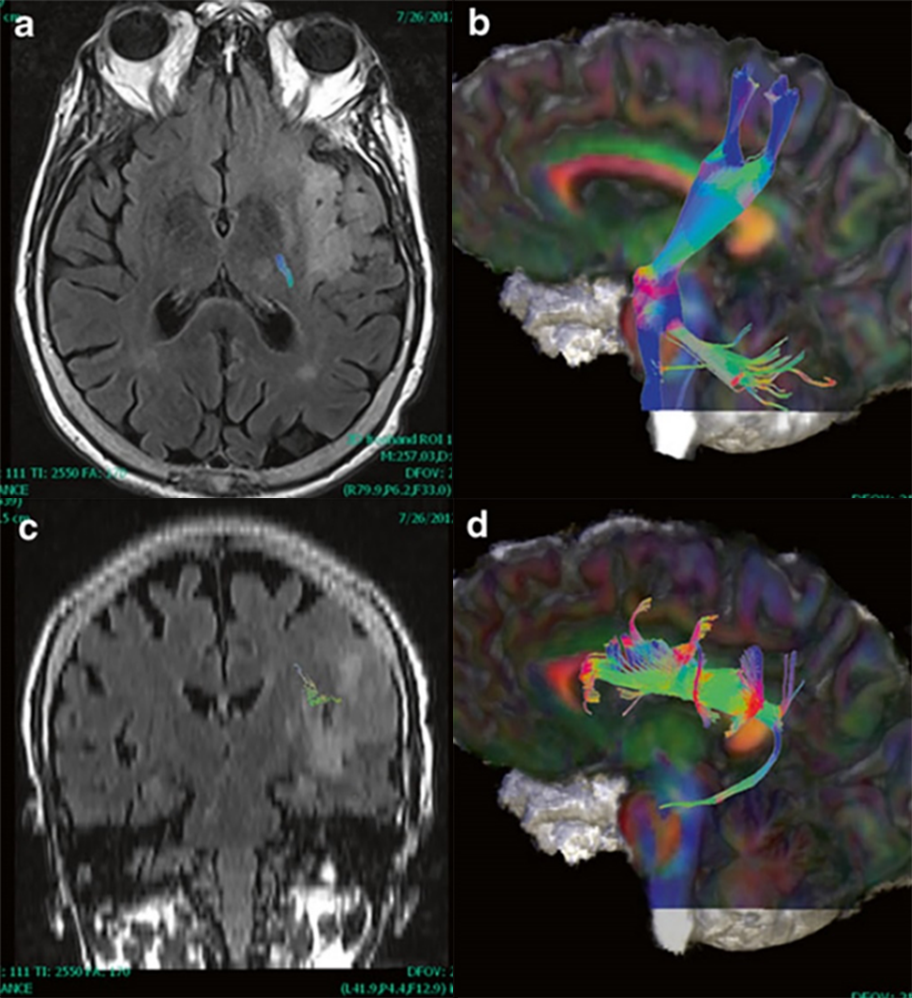
Slika 3. Tumor je pomerio kortikospinalni put u levoj hemisferi. Primenom DTI možemo precizno da utvrdimo položaj KSP u odnosu na tumor. Snimci su sa uređaja General Electric 1.5T iz Bolnice sveti Sava u Beogradu, iz mog kliničkog rada.
Slika 4. Određivanje položaja kortikospinalnog puta u neposrednoj blizini tumora u skolpu preoperativnog planiranja. Na T2 imidžima smo prikazali položaj kortikospinalnog puta. Snimanja sam uradila na uređaju General Electric 1.5T u Kliničkom centru Vojvodine.
Vid i jezik
Optička radijacija (OR) i posebno Mejerova petlja ne mogu lako da se vizualizuju primenom DTI traktografije. Problem predstavlja anatomija sa uskim zavijucima i lokacija duž medijalnog temporalnog lobusa gde artefakti magnetne susceptibinosti utiču na kvalitet DTI imidža (34,35).
Traktografija jezičkih puteva se takođe još uvek razvija i manje se koristi u kliničkom radu u odnosu na traktografiju piramidnog puta. Primenjuje se za lezije u blizini superiornog longitudinalnog/ arkuatnog fascikulusa u dominantnoj hemisferi.
Smanjenje radijacionog oštećenja elokventnih puteva bele mase
Koncept maksimalne moguće poštede elokventnih struktura koji se primenjuje u hirurgiji se proširio i na radiohirurgiju i druge terapijske radijacione pristupe. Traktografija kortikospinalnog puta, optičke radijacije i arkuatnog fascikulusa u funkciji radiohirurgije arrerijsko-venskih malformata omogućava da se prilagode doze zračenja i obezbedi rastojanje od 5 mm od svakog od ovih važnih puteva bele mase (36). DTI daje veliki doprinos proceni obima infiltracije (36-40), povećava preciznost dijagnoze, procenjuje gradus i prognozu, analizira odgovor na terapiju i može da predvidi recidiv. Koristi se tzv. volumen visokog rizika baziran na DTI koji omogućava smanjenje zračnog volumena za 35% (38).
Uloga difuzionog tenzorskog imidžinga u karakterizaciji i diferencijalnoj dijagnozi lezija u mozgu
Nalaz imidžinga za tumore mozga je često nespecifičan na konvencionalnoj magnetnoj rezonanci. Niskogradusni tumori kao i visokogradusni, metastaze, i limfomi pokazuju varijabilni visoki signal na FLAIR i T2, i hipo-izointenzni su na T1 imidžima, sve lezije mogu da pokažu neki nivo pojačanja na T1 imidžima posle primene kontrasta. Netumorske lezije kao što su akutni i subakutni infarkti, tumefaktivna demijelinizacija, abscesi, hematomi mogu da budu komplikovani za razlikovanje. Napredne neuroimidžing tehnike kao što je DWI i DTI, u kombinaciji sa MR spektroskopijom i perfuzijom daju veliki doprinos dobijanju preciznije dijagnoze.
Razlikovanje cisti, tumora i apscesa
Utvrđene su značajne razlike u brojnim vrednostima frakcione anizotropije (FA) u neposrednom perilezionom edemu kod apscesa u odnosu na tumore. Vrednosti FA su povišene u perilezionom edemu kod glioblastoma multiforme i kod metastaza (41-43). Suprotno tome, apscesi u mozgu imaju niže vrednosti FA u peritumorskoj zoni edema. Povišene vrednosti FA u neposrednom okruženju tumora su verovatno rezultat kompresivnog efekta i glioze. Pojava glioze je reakcija astrocita koja nastaje kao odgovor na bilo koju povredu centralnog nervnog sistema, kod apscesa će postojati kratko u odnosu na tumor. Vrednosti FA u jezgru apscesa su povišene u poređenju sa glioblastomom multiforme i metastazom (43,44). Visoke vrednosti FA u jezgru apscesa su posledica viskoznosti i prisustva makromolekula u gnoju (41). Vrednosti FA su visoke i u zoni kružnog postkontrastnog pojačanja zbog koncentričnih slojeva vlakana kolagena (41,45,46).
Razlikovanje Glioblastoma Multiforme od Metastaze
Kada se kod onkoloških bolesnika pojave multiple lezije u mozgu, dijagnoza metastaza se relativno jednostavno postavlja koristeći konvencionalni MRI i istoriju bolesti. Ali kada se pojavi solitarna lezija u mozgu, a nije poznato da li postoji primarni malignitet, dijagnoza može da bude komplikovana. Visokogradusni gliomi i solitarne metastaze imaju slične karakteristike na konvencionalnom MR imidžingu u pogledu intenziteta signala i načina postkontrastnog bojenja (47, 48-50). Pored toga, nemoguće je proceniti obim tumorske infiltracije, ako se primenjuje samo konvencionalni-morfološki MRI. Brojne vrednosti difuzionih koeficijenata (ADC) za visokogradusne gliome i metastaze se preklapaju tako da nisu od koristi za njihovo razlikovanje (51-59). Kod metastaza i neinfiltrativnih primarnih tumora mozga kao što je meningeom, peritumorski edem je vazogeni edem. Kod visokogradusnih glioma je peritumorski edem vazogeni edem sa elementima infiltracije (58). Zbog toga je za razlikovanje ova dva entiteta potrebno da se detektuju promene u peritumorskoj regiji, izvan granica postkontrastnog bojenja (58). Prema rezultatima brojinih istraživanja, DTI može da doprinese razlikovanju vazogenog edema koji okružuje metastaze od tumorske infiltracije kod glioma (60,43,61-63).
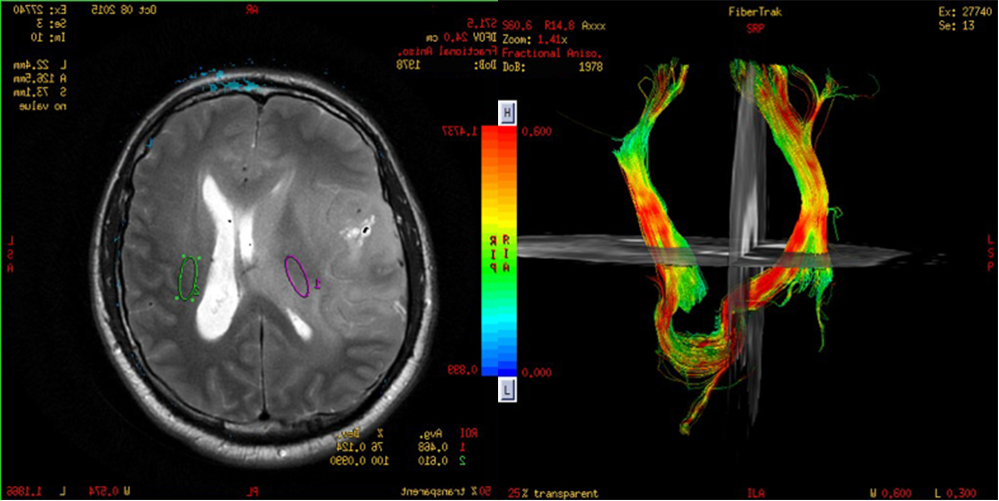
U Peritumorskoj regiji kod metastaza se ne nalaze tumorske ćelije. Vrednosti frakcione anizotropije FA (jedan od kvantitativnih parametara koji se dobijaju primenom DTI) se smanjuju sa porastom ćelijske gustine, odnosno sa infiltracijom. Skalarne DTI mere: p, q, i L, koje predstavljaju izotropnu difuziju, anizotropnu difuziju, i ukupnu veličinu difuzionog tenzora respektivno (62) obezbeđuju dodatni uvid u tumorsku infiltraciju (64). Na slici 5 je prikazana primena DTI u razlikovanju glioblastoma multiforme od metastaze.
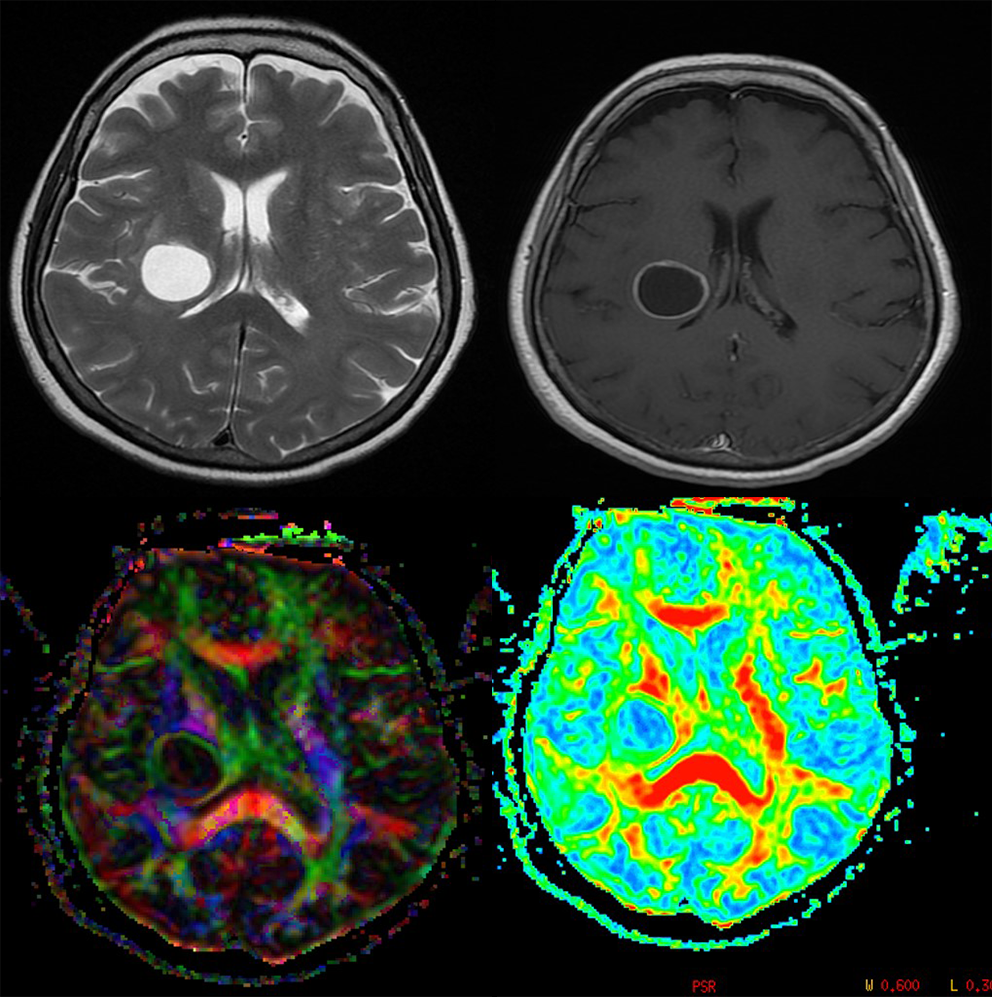
Slika 5. DTI može da pomogne u razlikovanju glioblastoma multiforme od metastaze. Prve dve slike prikazuju T2 i T1 postkontrastni imidž koji nisu dovoljno specifični. Treća i četvrta slika prikazuju DTI mape koje su karakteristične za visokogradusni infiltrativni tumor, što je dokazano histopatološki. Snimci su iz Bolnice Sveti Sava u Beogradu, 1.5T GE.
Meningeom
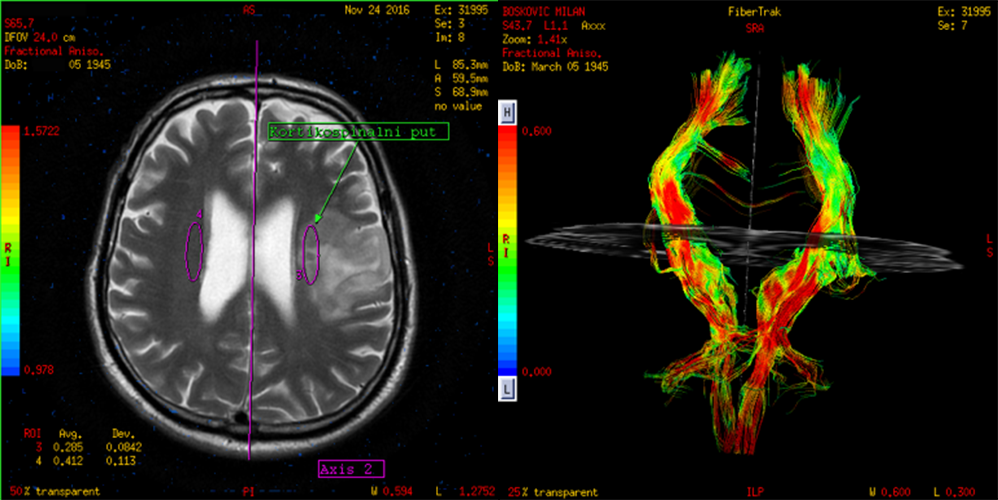
Dijagnoza meningeoma u većini situacija ne predstavlja problem za konvencionalni MRI. Ipak postoje situacije kada je veoma teško da se meningeom razlikuje od intra-aksijalnih tumora. Većina meningeoma su dobro organizovani tumori, organizacija se razlikuje kod različitih podtipova. Meningiotelijalni meningeomi su najčešći, sastoje se od ćelija organizovanih u lobule ili prstenove. Fibroblastni meningeomi se sastoje od vretenastih ćelija s jezgrima raspoređenim u fascikule. Kod atipičnih i zloćudnih meningeoma nema kohezije tumorskih ćelija, gubi se histološka struktura. Vrednosti DTI frakcione anizotropije FA odražavaju razlike u mikrostrukturi i mogu da pomognu u razlikovanju fibroblastnih meningeoma od ostalih benignih podtipova (65) i atipične ili maligne meningeome od benignih (66). Preoperativno planiranje za meningeome zahteva informacije o lokaciji tumora, veličini i konzistenciji. Kod meningeoma gradusa I je konzistentnost lezije (koju možemo da utvrdimo pomoću DTI) važan faktor koji određuje ishod hirurgije. Na primer, čvrsta struktura fibroblastnih podtipova je teža za odstranjivanje (67). Meki tumori mogu da se usisaju tako da je hirurgija jednostavnija posebno u blizini nerava i krvnih sudova. Potrebno je manje vremena za operaciju i ishod je obično bolji u poređenju sa čvrstim meningeomima. Konvencionalni MRI ne može da razlikuje podtipove i graduse. Na DTI snimcima su vrednosti FA povišene kod fibroblastnih meningeoma u odnosu na meningotelijalne.
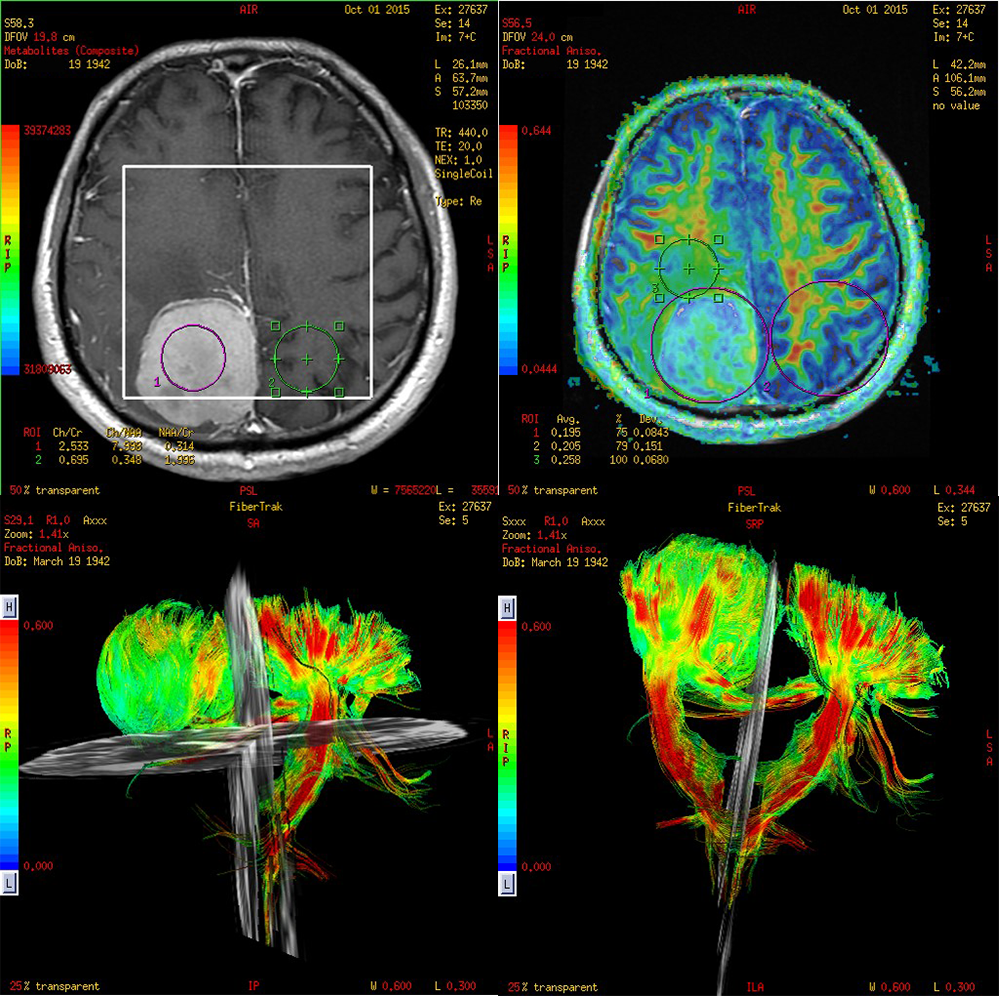
Slika 6. DTI i traktografija meningeoma. Snimci su iz Bolnice Sveti Sava u Beogradu, uređaj GE 1.5T.
Utvrđivanje granica tumora
U preoperativnom planiranju je za hirurga veoma važan precizan prostorni odnos tumora i okolnih puteva bele mase. Da bi se umanjio postoperativni neurološki deficit potrebno je i poznavanje tačnih granica tumora. Korišćenjem DTI, na osnovu anizotropije i pravca tj. orijentacije vlakana je izvršena kategorizacija na četiri osnovna načina zahvatanja puteva bele mase (7, 8). Prvi način vrednosti FA su normalne ili samo blago snižene, pomerene iz očekivane lokacije usled efekta mase. To znači da su putevi bele mase intaktni i da mogu da budu očuvani u hirurškoj proceduri. Drugi način: vrednosti FA su značajno snižene, lokacija puteva je uobičajena kao i pravac, nema pomeranja. Ovaj DTI obrazac okolne bele mase se uočava u vazogenom edemu koji okružuje tumore kao što su metastaze i meningeomi. Treći način pokazuje još veći pad vrednosti FA sa izmenjenim bojama na DTI mapi koja prikazuje pravce prostiranja puteva. Ovaj obrazac može da se identifikuje kod određenog broja infiltrativnih glioma. Infiltracija narušava organizaciju i pravce puteva i time prouzrokuje promenu boja na DTI mapi pravaca u boji (7). Četvrti način predstavlja izotropnu ili skoro izotropnu difuziju tako da trakt ne može da bude identifikovan na DTI mapama u boji koje prikazuju pravce prostiranja vlakana. Ovaj obrazac se uočava kada je deo puta bele mase potpuno prekinut.
Primena DTI u multiploj sklerozi i drugim demijelinizacionim bolestima
DTI se široko primenjuje za merenje i gradiranje u multiploj sklerozi, ne samo u T2 vidljivim lezijama bele mase, koristi se i za detektovanje mikrostrukturnih promena u beloj i sivoj moždanoj masi koje izgledaju zdravo na konvencionalnim MRI snimcima, zatim u optičkom nervu i kičmenoj moždini kod osoba sa različitim stadijumima bolesti (70,71). Tako opsežna primena DTI je značajno doprinela boljem razumevanju različitih patofizioloških supstrata bolesti i kompleksnosti njenih kliničkih manifestacija i evolucije. DTI se takođe koristi za kvantifikovanje zahvatanja CNS kod drugih demijelinizacionih stanja koja mogu da oponašaju multiplu sklerozu kao što je neuromijelitis optika (NMO) i akutni diseminirani encefalomijelitis (ADEM).
DTI karakteristike multiple skleroze
Fokalne lezije bele mase
DTI može da doprinese gradiranju oštećenja u fokalnim MS lezijama, koje tipično pokazuju povišene vrednosti parametra srednja difuzivnost engl. mean diffusivity (MD) i sniženu frakcionu anizotropiju (FA). Odstupanja DTI parametara su heterogena u različitim lezijama (70,71). Najveće promene se registruju u T1 hipointenznim lezijama (72-74), koje predstavljaju zone ireverzibilnog oštećenja tkiva, glioze i gubitka aksona. Suprotno tome, rezultati nisu toliko usaglašeni kada su vršena poređenja lezija koje se boje sa lezijama koje se ne boje posle primene kontrasta (72-75), ali najveći broj studija ukazuje na niske FA vrednosti u lezijama koje se boje (74,76). Ovi rezultati sugerišu da pomoću DTI može da se napravi gradacija unutrašnjih poremećaja u akutnim lezijama, koji mogu da predstavljaju različite supstrate od kojih su neki prolaznog karaktera (na primer edem, demijelinizacija i remijelinizacija) i drugi koji su trajni (neurodegeneracija i gubitak aksona). Praćenjem lezija MS koje se boje posle primene kontrasta od 1-3 meseca (75) je utvrđeno da su vrednosti MD povišene u svim lezijama, ali MD porast se nastavlja tokom praćenja samo u nekim podgrupama lezija. Ovaj rezultat naglašava činjenicu da kontrastno pojačanje ne obezbeđuje razlikovanje akutnih MS lezija, kod kojih mogu da budu prisutni različiti stepeni oštećenja tkiva. Restrikcija difuzije se pojavljuje kod manjeg broja lezija nego što je to slučaj kod akutnih vaskularnih neuroloških bolesti, i to u akutnoj fazi formiranja lezija ADEM i MS (77-79).
Bela masa koja izgleda zdravo
Bela masa koja izgleda zdravo na konvencionalnim MRI sekvencama kod osoba sa multiplom sklerozom uvek pokazuje porast MD i pad FA na DTI mapama (70,71), i pre formiranja novih fokalnih lezija (80). Ova odstupanja mogu da se registruju i u najranijim stadijumima bolesti, takođe i kod osoba sa kliničkim izolovanim sindromom (CIS) (81,82), i postaju više izražena sa dužinom trajanja bolesti i pogoršanjem neurološkog nalaza (70,71). Oštećenja bele mase koja izgleda zdravo su veća u perilezionim zonama (83,84) i na mestima gde su MS lezije tipično locirane (74,85). Oštećenja bele mase koja izgleda zdravo samo su delimično povezana sa opsegom T2 lezija i težinom oštećenja u samim lezijama (3), što sugeriše da promene difuzivnosti u beloj masi koja izgleda zdravo nisu u potpunosti zavisne od degeneracije aksona u samim lezijama, više predstavljaju difuzna oštećenja koja može da registruje samo DTI jer su izvan rezolucije konvencionalne MRI. Primenom DTI i perfuzije u korpus kalozumu kod relapsno-remitirajućeg oblika multiple skleroze su dobijeni rezultati koji više odgovaraju primarnoj ishemiji nego sekundarnoj hipoperfuziji usled Valerijanove degeneracije (86). Smatra se da su oštećenja nastala usled vaskularnih poremećaja i da su reverzibilna, dok bi hipometabolizam kao rezultat degeneracije aksona predstavljao uznapredovalo i ireverzibilno stanje. DTI se koristi i za praćenje evolucije MS oštećenja tokom vremena (81,87). Promene DTI parametara su nezavisne od akumulacije fokalnih lezija i smanjenja volumena sive mase (87). Tako da primena DTI u praćenju evolucije oštećenja tkiva u MS tokom vremena pruža mogućnosti za praćenje efekata neuroprotektivne terapije.
Slika 7. Tipična DTI slika demijelinizacije. Uvek ima puno vlakana u lezijama zato što ne stradaju sami putevi. Bolnica Sveti Sava Beograd 1.5T GE magnet.
Siva masa
Odstupanja u parametrima DTI su prisutna i u sivoj masi kod osoba sa MS (70,71,85,88,89). Više su izražena kod pacijenata sa progresivnom formom bolesti (71,89,90), posebno kod onih sa sekundarno progresivnom (SP) MS (89). Ove promene registrovane pomoću DTI se kod pacijenata sa SPMS i primarno-progresivnom (PP) MS (91,92), kao i kod onih sa RRMS (93) i CIS (94), pogoršavaju tokom vremena. Stepen DTI oštećenja sive mase je u korelaciji sa stepenom kognitivnog oštećenja kod blago onesposobljenih RRMS pacijenata (95) i može da predvidi petogodišnji razvoj bolesti kod PPMS (3). Više vrednosti DTI parametra MD se registruju u dubokim strukturama sive mase kod MS pacijenata, posebno u talamusu (96). Ova odstupanja su više izražena kod SPMS u odnosu na RRMS pacijente (96). Promene u difuzivnosti sive mase se objašnjavaju retrogradnom degeneracijom neurona prouzrokovanom oštećenjima puteva bele mase (97) kao i prisustvom MS lezija sive mase koje ne mogu da se detektuju drugim metodama.
Kortikalne lezije
Patološke i MRI studije pokazuju da su kortikalne lezije česte u MS, posebno u progresivnim formama bolesti. Primenom DTI je utvrđeno da intrakortikalne MS lezije imaju povišene vrednosti FA (98,99), što odražava gubitak dendrita, oštećenje neurona i aktivaciju mikroglijalnih ćelija. Kvantifikovanje oštećenja u kortikalnim lezijama primenom DTI može da pomogne u razlikovanju kliničkih MS fenotipa, posebno benignog (B) od SPMS (99).
Optički nerv
Uvođenje novih tehnika (ZOOM-EPI) visoke rezolucije sa supresijom masti i cerebrospinalnog fluida omogućava potpunu DTI analizu optičkog nerva (100-102). U hroničnoj fazi optičkog neuritisa, vrednosti MD bolesnog optičkog nerva su značajno više u odnosu na zdravo oko i u odnosu na vrednosti izmerene kod zdravih dobrovoljaca (101). Rezultati DTI su u saglasnosti sa vizuelnim evociranim potencijalima (101), gubitkom oštrine vida (101, 103), stanjivanjem retine na optičkoj koherentnoj tomografiji (103). Dokazano je da su sniženi FA i volumen optičkog nerva kod optičkog neuritisa faktori koji nezavisno predviđaju stepen gubitka vida (104).
Kičmena moždina
U lezijama kičmene moždine obolelih od multiple skleroze su vrednosti MD povišene (105). Vrednosti DTI parametara su izmenjene u vratnom delu kičmene moždine i kada su lezije prisutne samo u mozgu kod pacijenata sa MS (106,107) i optičkim neuromijelitisom (108) ali ne kod onih sa CIS (109). Oštećenje kičmene moždine izvan fokalnih lezija je difuzno kod SPMS, a više je ograničeno kod BMS pacijenata (110). Brojne studije su pokazale da su DTI mere u mozgu i kičmenoj moždini nezavisno povezane sa kliničkom slikom (87,107,108).
ADEM
Akutni diseminirani encefalomijelitis (ADEM) se definiše kao monofazna, imunološki uslovljena demijelinizaciona bolest, najčešće se javlja kod dece, obično mu prethodi infekcija ili vakcinacija. Uloženi su veliki napori u pokušaje da se definišu MRI parametri koji mogu da razlikuju ADEM od MS. Ako primenjujemo DTI, kod ADEM pacijenata nema odstupanja u beloj masi koja izgleda zdravo kao ni u kičmenoj moždini posle akutne faze bolesti (za razliku od MS) (111). Postoje samo blaga DTI odstupanja u bazalnim ganglijama (112).
Konvencionalni MRI ima nisku specifičnost za razlikovanje heterogenih patoloških supstrata inflamatornih i demijelinizacionih bolesti CNS. Dokazano je da DTI može da kvantifikuje oštećenje tkiva u fokalnim lezijama kao i suptilnija odstupanja u fokalnim lezijama u beloj masi koja izgleda zdravo, sivoj masi, kičmenoj moždini i optičkom nervu.
Ishemija
DTI parametar frakciona anizotropija (FA) se povećava u akutnoj fazi i smanjuje se značajno u hroničnoj fazi zbog strukturne dezorganizacije ishemijske bele mase. Iako ADC vrednosti ostaju povišene u hroničnoj fazi, FA nastavlja da se smanjuje i do šest meseci posle infarkta mozga. Udružena analiza ADC i FA može da se koristi za procenu težine ishemije i dugoročnog ishoda. FA opada u zonama leukoarajoze, uz povišen T2 signal na konvencionalnom MRI, vrednosti MD su povišene ali je porast značajno manji u poređenju sa zonama ishemije (113). Zato DTI može pouzdano da razlikuje klinički značajan infarkt od ishemijske leukoarajoze.
Poremećena motorika posle infarkta mozga
O piramidalnm tj. kortikospinalnom putu smo govorili u kontekstu očuvanja motornih funkcija u prehirurškom planiranju kod tumora mozga. To je glavni put neurona u ljudskom mozgu za motoriku distalnih ekstremiteta, zbog toga je očuvanje i oporavak ovog puta osnova za oporavak oštećenih motornih funkcija posle infarkta mozga. DTI može da se koristi za evaluaciju integriteta piramidalnog puta kod ishemije (114,115). U velikim meta-analizama je dokazana jaka korelacija DTI vrednosti frakcione anizotropije (FA) i oporavka motornih funkcija ekstremiteta kod ishemijskog i hemoragijskog infarkta (116,117). Pad vrednosti FA je u inverznoj korelaciji sa poboljšanjem neurološkog nalaza i motornih funkcija (118). DTI se uspešno koristi za evaluaciju efikasnosti programa rehabilitacije (119). Broj i dužina vlakana piramidalnog puta su se značajno povećali posle 8 nedelja vežbanja ruke (120).
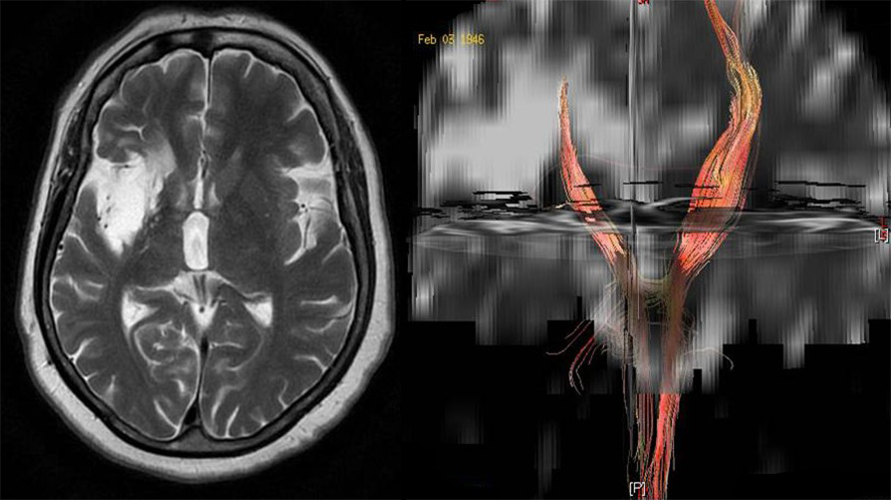
Slika 8. DTI može da prikaže Valerijanovu degeneraciju u situaciji na slici je nastala kao posledica ishemije.Bolnica Sveti Sava Beograd, uređaj 1.5T GE.
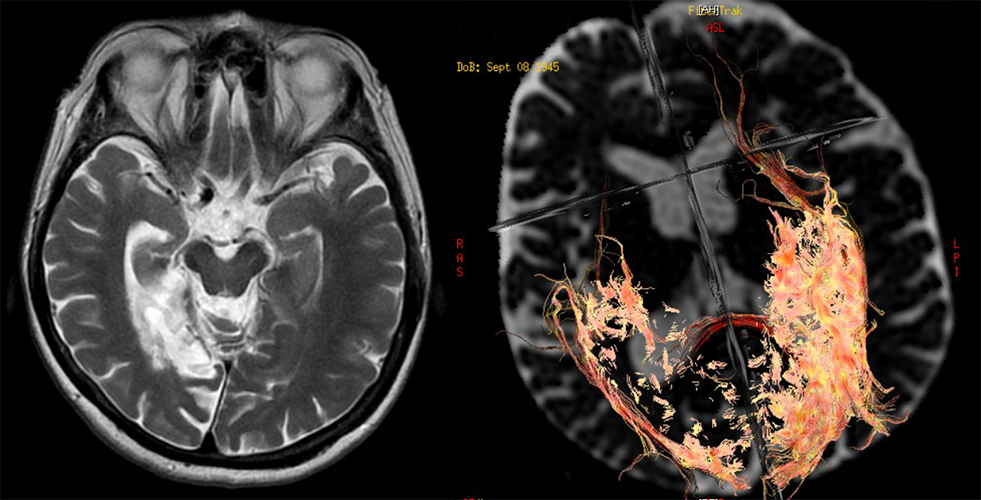
Slika 9. Ishemija, za razliku od demijelinizacije oštećuje puteve. Bolnica Sveti Sava Beograd 1.5T GE.
Oštećenje govora posle infarkta mozga
Arkuatni fascikulus (AF) je važan put za jezičke funkcije, povezuje regije Broke i Vernikea (121, 122). FA, MD, i broj vlakana dobijeni korišćenjem DTI mogu da detektuju lezije koje nisu vidljive na konvencionalnom MRI mozga (123). DTI praćenje omogućava procenu oporavka puta: regeneracije, degeneracije, smanjenja peri AF edema (124). Gustina vlakana desnog AF se povećala kod pacijenata sa afazijom Broke (kao posledicom ishemije) posle intenzivne terapije melodijskom intonacijom (125). Evaluacija AF korišćenjem DTI može da pomogne u predviđanju oporavka afazije već u ranim fazama ishemije. Integritet AF je važan za ishod jezičkih funkcija kod afazije, promene do kojih dolazi zbog jezičke terapije i rezultirajuće plastične promene u putevima bele mase mogu da se mere korišćenjem DTI (126).
Traumatska povreda mozga
Mikroskopske povrede aksona u blagoj traumatskoj povredi mozga (TBI), ne mogu uvek da se detektuju konvencionalnim imidžingom mozga (127). Oštećenja bele mase koja nisu prepoznata povećavaju rizik za pojavu dugoročnog kognitivnog i funkcionalnog pogoršanja. DTI je koristan za detektovanje ovih ´skrivenih´ lezija i za razumevanje patofiziologije blage traumatske povrede mozga (128,129). DTI je jedna od najboljih metoda za registrovanje lezija u zonama koje su obično oštećene u TBI kao što je korona radijata anterior, uncinatni fascikulus, superiorni longitudinalni fascikulus i korpus kalozum (130,131). Izmenjena strukturalna konektivnost unutar i između hemisfera uključujući prefrontalni korteks je važna pojava u patofiziologiji blage TBI (129). Snižene vrednosti FA u ovim regijama pokazuju snažnu korelaciju sa deficitima u egzekutivnim funkcijama, memoriji i pažnji (132).
Uloga difuzionog tenzorskog imidžinga u patologiji kičme
Povreda kičmene moždine
Kliničke informacije kao što je nivo povrede, motorni i senzorni skorovi, i procena pogoršanja, su i dalje osnov za određivanje prognoze i vođenje terapije kod povreda kičmene moždine. Ovi podaci mogu da budu subjektivni, što ukazuje na potrebu za objektivnim imidžing modalitetima kao što je DTI da bi se obezbedio uvid u integritet aksona i da se prikaže stepen oštećenja aksona na mestu povrede i u okruženju(133-137). Na mestu povrede su vrednosti FA snižene u poređenju sa nepovređenim dobrovoljcima (137-141). Ova fokalna redukcija FA zavisi od intenziteta povrede, što daje DTI metodi ulogu u detektovanju objektivnih morfoloških promena tokom progresije od akutne do hronične faze povrede kičmene moždine (142) i tokom procesa oporavka (139,143). Longitudinalna analiza FA u centru promene može uspešno da prati progresiju degeneracije aksona, i da predvidi lokomotorni oporavak (144).
Tumori kičme
Kod tumora kičme je kao i kod tumora mozga za uspeh operacije i prognozu važna prostorna i morfološka veza tumora kičmene moždine i puteva bele mase, DTI traktografija može da prikaže pomeranje puteva bele mase u prisustvu lezija kičmene moždine (145-147).
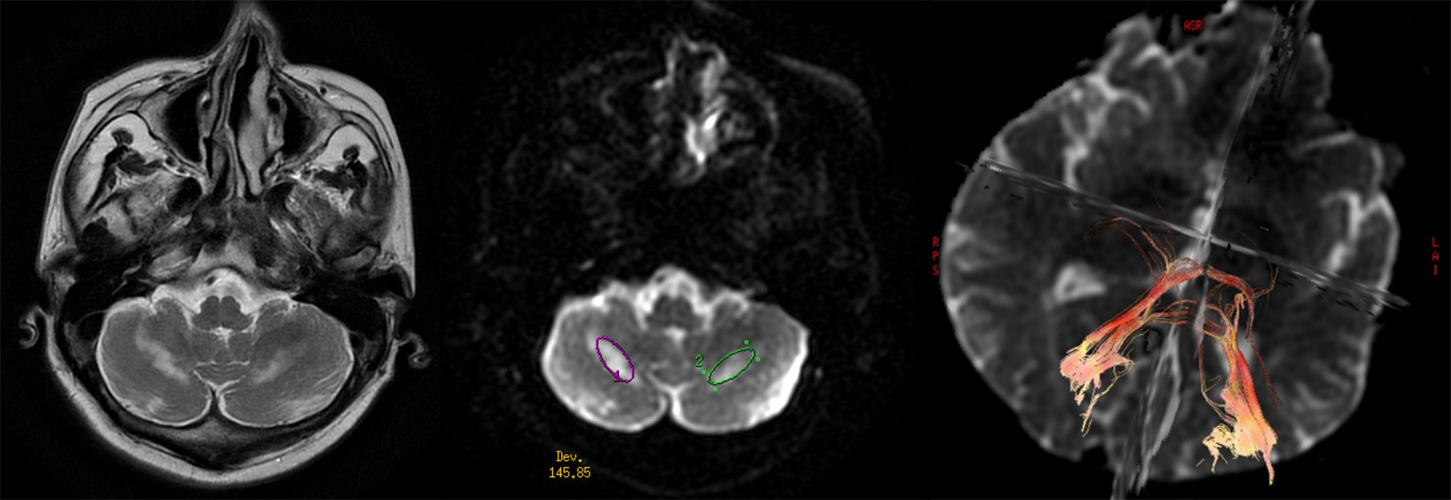
Konvencionalni MRI najčešće nije dovoljan za razlikovanje ependimoma od astrocitoma u kičmenoj moždini. DTI traktografija može da prikaže pomeranje vlakana kod ependimoma od infiltracije kod astrocitoma (148,149). Važna oblast primene DTI je i razlikovanje intramedularnih tumora od netumorskih lezija (slika 10), što može da bude dilema ako se primenjuje samo konvencionalni MRI.
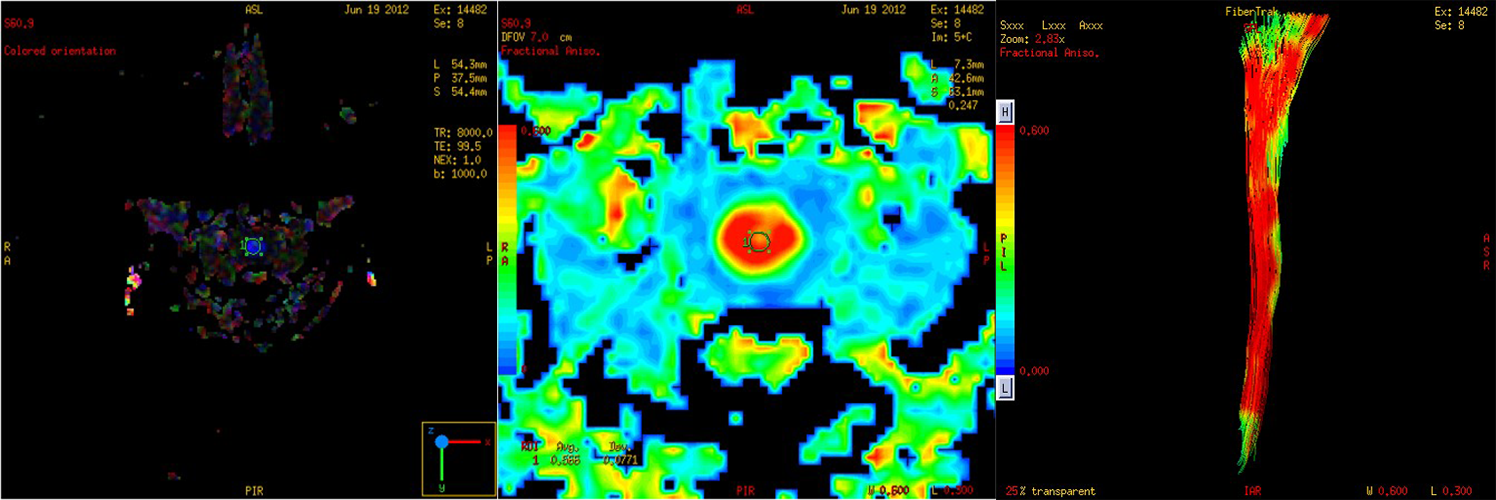
Slika 10. DTI kod pacijentkinje sa sumnjom na infiltraciju kičmene moždine. DTI sa traktografijom je otklonio ovu sumnju, kvantitativne mere DTI i traktografija govore u prilog inflamatorne lezije što je potvrđeno klinički i MRI praćenjem. Urađeno u Bolnici Sveti Sava u Beogradu na uređaju 1.5T GE.
Cervikalna spondilotična mijelopatija
Iako je konvencionalni MRI zlatni standard za evaluaciju kompresije kičmene moždine kod cervikalne spondilotične mijelopatije, MRI ne može konzistentno da okarakteriše obim povrede neurona ili funkcionalni status pacijenta, ni da prognozira oporavak posle hirurške dekompresije (150-152). Kičmena moždina često deluje normalno na MRI u ranim stadijumima cervikalne spondilotične mijelopatije (153) što može da odloži intervenciju, a time i oporavak (150). U ovakvim situacijama DTI može da prevaziđe ograničenja konvencionalnog MRI. Brojne studije su pokazale pad FA i porast MD kod cervikalne spondilotične mijelopatije (154-161). Promene FA su najizraženije na nivou maksimalne kompresije (162). Promene parametara DTI mogu da se detektuju pre pojave T2 hiperintenziteta na MRI (155). Promene frakcione anizotropije (FA) se najranije uočavaju (163) i pre pojave simptoma (164). Pad FA je u skladu sa podacima funkcionalne elektrofiziologije i sa izmenjenim senzornim evociranim potencijalima (SEPs) (165).
U DTI evaluaciji patologije kičme se koristi pristup odabira regije od interesa i merenja kvantitativnih parametara kao i DTI traktografija (tro-dimenzionalni prikaz puteva). Oba pristupa imaju široku kliničku primenu u patologiji kičmene moždine uključujući: ranu detekciju, hirurško planiranje, prognozu, diferencijalnu dijagnozu, razlikovanje patoloških subgrupa, i praćenje terapije. Strukturalni MRI ostaje prvi i najvažniji modalitet za evaluaciju patologije kičme. DTI, kao dopunska metoda može da detektuje patološka stanja u kičmenoj moždini i u situacijama kada konvencionalni MRI izgleda normalno. Zato DTI postaje, veoma koristan routinski dodatak konvencionalnom MRI za evaluaciju pacijenata sa spinalnom patologijom.
Literatura:
- Tae WS, Ham BJ, Pyun SB, Kang SH, Kim BJ. Current Clinical Applications of Diffusion-Tensor Imaging in Neurological Disorders. J Clin Neurol. 2018 Apr;14(2):129-140. doi: 10.3988/jcn.2018.14.2.129. Epub 2018 Feb 28.
- Zeineh MM, Holdsworth S, Skare S, Atlas SW, Bammer R. Ultra-high resolution diffusion tensor imaging of the microscopic pathways of the medial temporal lobe. Neuroimage 2012;62:2065-2082.
- Abhinav K, Yeh FC, Pathak S, Suski V, Lacomis D, Friedlander RM, et al. Advanced diffusion MRI fiber tracking in neurosurgical and neurodegenerative disorders and neuroanatomical studies: a review. Biochim Biophys Acta 2014;1842:2286-2297.
- W. Van Hecke et al. (eds.), Diffusion Tensor Imaging, © Springer Science+Business Media New York 2016 275 DOI 10.1007/978-1-4939-3118-7_13
- van Hecke W, Nagels G, Emonds G, Leemans A, Sijbers J, van Goethem J, et al. A diffusion tensor imaging group study of the spinal cord in multiple sclerosis patients with and without T2 spinal cord lesions. J Magn Reson Imaging. 2009;30(1):25–34 [Evaluation Studies].
- Vedantam A, Jirjis MB, Schmit BD, Wang MC, Ulmer JL, Kurpad SN. Diffusion tensor imaging of the spinal cord: insights from animal and human studies. Neurosurgery. 2014;74(1):1–8.
- Zhou Y, Narayana PA, Kumaravel M, Athar P, Patel VS, Sheikh KA. High resolution diffusion tensor imaging of human nerves in forearm. J Magn Reson Imaging. 2014;39(6):1374–83.
- Khalil C, Budzik JF, Kermarrec E, Balbi V, Le Thuc V, Cotten A. Tractography of peripheral nerves and skeletal muscles. Eur J Radiol. 2010;76(3):391–7 [Review].
- Wei H, Viallon M, Delattre BM, Wang L, Pai VM, Wen H, et al. Assessment of cardiac motion effects on the fi ber architecture of the human heart in vivo. IEEE Trans Med Imaging. 2013;32(10):1928–38 [Research Support, Non-U.S. Gov't].
- Furman-Haran E, Eyal E, Shapiro-Feinberg M, Nissan N, Grobgeld D, Weisenberg N, et al. Advantages and drawbacks of breast DTI. Eur J Radiol. 2012;81 Suppl 1:S45–7.
- Tagliafi co A, Rescinito G, Monetti F, Villa A, Chiesa F, Fisci E, et al. Diffusion tensor magnetic resonance imaging of the normal breast: reproducibility of DTIderived fractional anisotropy and apparent diffusion coeffi cient at 3.0 T. Radiol Med. 2012;117(6): 992–1003
- Froeling M, Nederveen AJ, Nicolay K, Strijkers GJ. DTI of human skeletal muscle: the effects of diffusion encoding parameters, signal-to-noise ratio and T2 on tensor indices and fi ber tracts. NMR Biomed. 2013;26(11):1339–52.
- Jaimes C, Darge K, Khrichenko D, Carson RH, Berman JI. Diffusion tensor imaging and tractography of the kidney in children: feasibility and preliminary experience. Pediatr Radiol. 2014;44(1):30–41.
- Notohamiprodjo M, Dietrich O, Horger W, Horng A, Helck AD, Herrmann KA, et al. Diffusion tensor imaging (DTI) of the kidney at 3 tesla-feasibility, protocol evaluation and comparison to 1.5 Tesla. Invest Radiol. 2010;45(5):245–54 [Comparative Study].
- Kim CK, Jang SM, Park BK. Diffusion tensor imaging of normal prostate at 3 T: effect of number of diffusion- encoding directions on quantitation and image quality. Br J Radiol. 2012;85(1015):e279–83 [Comparative Study].
- Gurses B, Kabakci N, Kovanlikaya A, Firat Z, Bayram A, Ulug AM, et al. Diffusion tensor imaging of the normal prostate at 3 Tesla. Eur Radiol. 2008;18(4):716–21.
- Fiocchi F, Nocetti L, Siopis E, Curra S, Costi T, Ligabue G, et al. In vivo 3 T MR diffusion tensor imaging for detection of the fibre architecture of the human uterus: a feasibility and quantitative study. Br J Radiol. 2012;85(1019):e1009–17.
- Holodny AI, Ollenschleger MD, Liu WC, Schulder M, Kalnin AJ. Identifi cation of the corticospinal tracts achieved using blood-oxygen-level-dependent and diffusion functional MR imaging in patients with brain tumors. AJNR Am J Neuroradiol. 2001;22:83–8.
- Smits M, Vernooij MW, Wielopolski PA, Vincent AJ, Houston GC, van der Lugt A. Incorporating functional MR imaging into diffusion tensor tractography in the preoperative assessment of the corticospinal tract in patients with brain tumors. AJNR Am J Neuroradiol. 2007;28:1354–61.
- Kamada K, Sawamura Y, Takeuchi F, et al. Functional identifi cation of the primary motor area by corticospinal tractography. Neurosurgery. 2005;56:98–109. Discussion 198-109.
- Chen X, Weigel D, Ganslandt O, Buchfelder M, Nimsky C. Diffusion tensor imaging and white matter tractography in patients with brainstem lesions. Acta Neurochir (Wien). 2007;149:1117–31. discussion 1131.
- Laundre BJ, Jellison BJ, Badie B, Alexander AL, Field AS. Diffusion tensor imaging of the corticospinal tract before and after mass resection as correlated with clinical motor fi ndings: preliminary data. AJNR Am J Neuroradiol. 2005;26:791–6.
- Mikuni N, Okada T, Enatsu R, et al. Clinical signifi -cance of preoperative fi bre-tracking to preserve the affected pyramidal tracts during resection of brain tumours in patients with preoperative motor weakness. J Neurol Neurosurg Psychiatry. 2007;78:716–21.
- 19. Nimsky C, Ganslandt O, Hastreiter P, et al. Preoperative and intraoperative diffusion tensor imaging- based fi ber tracking in glioma surgery. Neurosurgery. 2005;56:130–7. discussion 138.
- Nimsky C, Grummich P, Sorensen AG, Fahlbusch R, Ganslandt O. Visualization of the pyramidal tract in glioma surgery by integrating diffusion tensor imaging in functional neuronavigation. Zentralbl Neurochir. 2005;66:133–41.
- Gonzalez-Darder JM, Gonzalez-Lopez P, Talamantes F, et al. Multimodal navigation in the functional microsurgical resection of intrinsic brain tumors located in eloquent motor areas: role of tractography. Neurosurg Focus. 2010;28:E5
- Bello L, Gambini A, Castellano A, et al. Motor and language DTI Fiber Tracking combined with intraoperative subcortical mapping for surgical removal of gliomas. Neuroimage. 2008;39:369–82.
- Ulmer JL, Salvan CV, Mueller WM, et al. The role of diffusion tensor imaging in establishing the proximity of tumor borders to functional brain systems: implications for preoperative risk assessments and postoperative outcomes. Technol Cancer Res Treat. 2004;3: 567–76.
- Romano A, Ferrante M, Cipriani V, et al. Role of magnetic resonance tractography in the preoperative planning and intraoperative assessment of patients with intra-axial brain tumours. Radiol Med. 2007;112: 906–20.
- Wu JS, Zhou LF, Tang WJ, et al. Clinical evaluation and follow-up outcome of diffusion tensor imagingbased functional neuronavigation: a prospective, controlled study in patients with gliomas involving pyramidal tracts. Neurosurgery. 2007;61:935–48. Discussion 948-939.
- Keles GE, Lundin DA, Lamborn KR, Chang EF, Ojemann G, Berger MS. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways: evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg. 2004;100:369–75
- Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures. Neurosurg Focus. 2010;28:E8.
- Kamada K, Houkin K, Takeuchi F, et al. Visualization of the eloquent motor system by integration of MEG, functional, and anisotropic diffusion-weighted MRI in functional neuronavigation. Surg Neurol. 2003;59:352–61. discussion 361-352.
- Hofer S, Karaus A, Frahm J. Reconstruction and dissection of the entire human visual pathway using diffusion tensor MRI. Front Neuroanat. 2010;4:15.
- Mandelstam SA. Challenges of the anatomy and diffusion tensor tractography of the Meyer loop. AJNR Am J Neuroradiol. 2012;33:1204–10
- Koga T, Maruyama K, Kamada K, et al. Outcomes of diffusion tensor tractography-integrated stereotactic radiosurgery. Int J Radiat Oncol Biol Phys. 2012;82: 799–802.
- Gupta A, Shah A, Young RJ, Holodny AI. Imaging of brain tumors: functional magnetic resonance imaging and diffusion tensor imaging. Neuroimaging Clin N Am. 2010;20:379–400.
- Jena R, Price SJ, Baker C, et al. Diffusion tensor imaging: possible implications for radiotherapy treatment planning of patients with high-grade glioma. Clin Oncol (R Coll Radiol). 2005;17:581–90.
- Krishnan AP, Asher IM, Davis D, Okunieff P, O’Dell WG. Evidence that MR diffusion tensor imaging (tractography) predicts the natural history of regional progression in patients irradiated conformally for primary brain tumors. Int J Radiat Oncol Biol Phys. 2008;71:1553–62.
- Stadlbauer A, Nimsky C, Buslei R, et al. Diffusion tensor imaging and optimized fi ber tracking in glioma patients: histopathologic evaluation of tumor-invaded white matter structures. Neuroimage. 2007;34:949–56.
- Toh C, et al. Differentiation of brain abscesses from necrotic glioblastomas and cystic metastatic brain tumors with diffusion tensor imaging. AJNR Am J Neuroradiol. 2011;32(9):1646–51.
- Brandsma D, van den Bent MJ. Pseudoprogression and pseudoresponse in the treatment of gliomas. Curr Opin Neurol. 2009;22(6):633–8.
- Wang S, Kim S, Chawla S, Wolf RL, Zhang W-G, O’Rourke DM, et al. Differentiation between glioblastomas and solitary brain metastases using diffusion tensor imaging. Neuroimage. 2009;44(3): 653–60.
- Sinha S, Bastin ME, Whittle IR, Wardlaw JM. Diffusion tensor MR imaging of high-grade cerebral gliomas. AJNR Am J Neuroradiol. 2002;23(4):520–7.
- Gupta RK, Hasan KM, Mishra AM, Jha D, Husain M, Prasad KN, et al. High fractional anisotropy in brain abscesses versus other cystic intracranial lesions. AJNR Am J Neuroradiol. 2005;26(5):1107–14.
- Kumar M, Gupta RK, Nath K, Rathore RKS, Bayu G, Trivedi R, et al. Can we differentiate true white matter fibers from pseudofi bers inside a brain abscess cavity using geometrical diffusion tensor imaging metrics? NMR Biomed. 2008;21(6):581–8.
- Lu S, Ahn D, Johnson G, Cha S. Peritumoral diffusion tensor imaging of high-grade gliomas and metastatic brain tumors. AJNR Am J Neuroradiol. 2003;24(5): 937–41.
- Law M, Cha S, Knopp EA, Johnson G, Arnett J, Litt AW. High-grade gliomas and solitary metastases: differentiation by using perfusion and proton spectroscopic MR imaging. Radiology. 2002;222(3): 715–21.
- Tang YM, Ngai S, Stuckey S. The solitary enhancing cerebral lesion: can FLAIR aid the differentiation between glioma and metastasis? AJNR Am J Neuroradiol. 2006;27(3):609–11.
- Maurer M, Synowitz M, Badakshi H, Lohkamp L, Wüstefeld J, Schäfer ML, et al. Glioblastoma multiforme versus solitary supratentorial brain metastasis: differentiation based on morphology and magnetic resonance signal characteristics. Fortschr Röntgenstr. 2013;185(03):235–40.
- Kono K, Inoue Y, Nakayama K, Shakudo M, Morino M, Ohata K, et al. The role of diffusion-weighted imaging in patients with brain tumors. AJNR Am J Neuroradiol. 2001;22(6):1081–8.
- Stadnik TW, Chaskis C, Michotte A, Shabana WM, van Rompaey K, Luypaert R, et al. Diffusionweighted MR imaging of intracerebral masses: comparison with conventional MR imaging and histologic findings. AJNR Am J Neuroradiol. 2001;22(5): 969–76.
- Bulakbasi N, Kocaoglu M, Ors F, Tayfun C, Uçöz T. Combination of single-voxel proton MR spectroscopy and apparent diffusion coeffi cient calculation in the evaluation of common brain tumors. AJNR Am J Neuroradiol. 2003;24(2):225–33.
- Yamasaki F, Kurisu K, Satoh K, Arita K, Sugiyama K, Ohtaki M, et al. Apparent diffusion coeffi cient of human brain tumors at MR imaging. Radiology. 2005;235(3):985–91.
- Calli C, Kitis O, Yunten N, Yurtseven T, Islekel S, Akalin T. Perfusion and diffusion MR imaging in enhancing malignant cerebral tumors. Eur J Radiol. 2006;58(3):394–403.
- Rollin N, Guyotat J, Streichenberger N, Honnorat J, Tran Minh V-A, Cotton F. Clinical relevance of diffusion and perfusion magnetic resonance imaging in assessing intra-axial brain tumors. Neuroradiology. 2006;48(3):150–9.
- Pavlisa G, Rados M, Pavlisa G, Pavic L, Potocki K, Mayer D. The differences of water diffusion between brain tissue infi ltrated by tumor and peritumoral vasogenic edema. J Clin Imaging. 2009;33(2):96–101.
- Lee EJ, terBrugge K, Mikulis D, Choi DS, Bae JM, Lee SK, et al. Diagnostic value of peritumoral minimum apparent diffusion coeffi cient for differentiation of glioblastoma multiforme from solitary metastatic lesions. Am J Roentgenol. 2011;196(1):71–6.
- Server A, Kulle B, Mæhlen J, Josefsen R, Schellhorn T, Kumar T, et al. Quantitative apparent diffusion coeffi cients in the characterization of brain tumors and associated peritumoral edema. Acta Radiol. 2009;50(6):682–9
- Zhou X, et al. A DTI study of glioma infi ltration using fractional anisotropy and fi ber coherence index. Proc Intl Soc Mag Reson Med. 2007;15:344.
- Kallenberg K, Goldmann T, Menke J, Strik H, Bock HC, Stockhammer F, et al. Glioma infi ltration of the corpus callosum: early signs detected by DTI. J Neurooncol. 2013;112(2):217–22.
- Price SJ, Peña A, Burnet NG, Pickard JD, Gillard JH. Detecting glioma invasion of the corpus callosum using diffusion tensor imaging. Br J Neurosurg. 2004;18(4):391–5.
- Price SJ, Jena R, Burnet NG, Carpenter TA, Pickard JD, Gillard JH. Predicting patterns of glioma recurrence using diffusion tensor imaging. Eur Radiol. 2007;17(7):1675–84.
- Wang W, Steward C, Desmond P. Diffusion tensor imaging in glioblastoma multiforme and brain metastases: the role of p, q, L, and fractional anisotropy. AJNR Am J Neuroradiol. 2008;30(1):203–8.
- Tropine A, Dellani PD, Glaser M, Bohl J, Plöner T, Vucurevic G, et al. Differentiation of fi broblastic meningiomas from other benign subtypes using diffusion tensor imaging. J Magn Reson Imaging. 2007; 25(4):703–8.
- Toh C-H, Castillo M, Wong A-C, Wei K-C, Wong H-F, Ng S-H, et al. Differentiation between classic and atypical meningiomas with use of diffusion tensor imaging. AJNR Am J Neuroradiol. 2008;29(9): 1630–5.
- Kashimura H, Inoue T, Ogasawara K, Arai H, Otawara Y, Kanbara Y, et al. Prediction of meningioma consistency using fractional anisotropy value measured by magnetic resonance imaging. J Neurosurg. 2007;107(4):784–7.
- Jellison BJ, Field AS, Medow J, Lazar M, Salamat MS, Alexander AL. Diffusion tensor imaging of cerebral white matter: a pictorial review of physics, fiber tract anatomy, and tumor imaging patterns. AJNR Am J Neuroradiol. 2004;25(3):356–69.
- Toh C, et al. Differentiation of brain abscesses from necrotic glioblastomas and cystic metastatic brain tumors with diffusion tensor imaging. AJNR Am J Neuroradiol. 2011;32(9):1646–51.
- Rovaris M, Gass A, et al. Diffusion MRI in multiple sclerosis. Neurology. 2005;65(10):1526–32.
- Rovaris M, Agosta F, et al. Diffusion tensor MR imaging. Neuroimaging Clin N Am. 2009;19(1):37–43.
- Bammer R, Augustin M, et al. Magnetic resonance diffusion tensor imaging for characterizing diffuse and focal white matter abnormalities in multiple sclerosis. Magn Reson Med. 2000;44(4):583–91.
- Filippi M, Iannucci G, et al. A quantitative study of water diffusion in multiple sclerosis lesions and normal- appearing white matter using echo-planar imaging. Arch Neurol. 2000;57(7):1017–21.
- Filippi M, Cercignani M, et al. Diffusion tensor magnetic resonance imaging in multiple sclerosis. Neurology. 2001;56(3):304–11.
- Castriota-Scanderbeg A, Sabatini U, et al. Diffusion of water in large demyelinating lesions: a follow-up study. Neuroradiology. 2002;44(9):764–7.
- Werring DJ, Clark CA, et al. Diffusion tensor imaging of lesions and normal-appearing white matter in multiple sclerosis. Neurology. 1999;52(8):1626–32.
- Tievsky AL, Ptak T, et al. Investigation of apparent diffusion coeffi cient and diffusion tensor anisotropy in acute and chronic multiple sclerosis lesions. AJNR Am J Neuroradiol. 1999;20(8):1491–9.
- Bernarding J, Braun J, et al. Diffusion- and perfusion weighted MR imaging in a patient with acute demyelinating encephalomyelitis (ADEM). J Magn Reson Imaging. 2002;15(1):96–100.
- Abou Zeid N, Pirko I, et al. Diffusion-weighted imaging characteristics of biopsy-proven demyelinating brain lesions. Neurology. 2012;78(21):1655–62.
- Rocca MA, Cercignani M, et al. Weekly diffusion weightedimaging of normal-appearing white matter in MS. Neurology. 2000;55(6):882–4.
- Gallo A, Rovaris M, et al. Diffusion-tensor magnetic resonance imaging detects normal-appearing white matter damage unrelated to short-term disease activity in patients at the earliest clinical stage of multiple sclerosis. Arch Neurol. 2005;62(5):803–8.
- Preziosa P, Rocca MA, et al. Intrinsic damage to the major white matter tracts in patients with different clinical phenotypes of multiple sclerosis: a voxelwise diffusion-tensor MR study. Radiology. 2011;260(2):541–50.
- Guo AC, Jewells VL, et al. Analysis of normalappearing white matter in multiple sclerosis: comparison of diffusion tensor MR imaging and magnetization transfer imaging. AJNR Am J Neuroradiol. 2001; 22(10):1893–900.
- Hasan KM, Gupta RK, et al. Diffusion tensor fractional anisotropy of the normal-appearing seven segments of the corpus callosum in healthy adults and relapsing-remitting multiple sclerosis patients. J Magn Reson Imaging. 2005;21(6):735–43.
- Cercignani M, Bozzali M, et al. Magnetisation transfer ratio and mean diffusivity of normal appearing white and grey matter from patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2001;70(3):311–7.
- Saindane AM, Law M, et al. Correlation of diffusion tensor and dynamic perfusion MR imaging metrics in normal-appearing corpus callosum: support for primary hypoperfusion in multiple sclerosis. AJNR Am J Neuroradiol. 2007;28(4):767–72.
- Agosta F, Absinta M, et al. In vivo assessment of cervical cord damage in MS patients: a longitudinal diffusion tensor MRI study. Brain. 2007;130(Pt8):2211–9.
- Bozzali M, Cercignani M, et al. Quantifi cation of brain gray matter damage in different MS phenotypes by use of diffusion tensor MR imaging. AJNR Am J Neuroradiol. 2002;23(6):985–8.
- Rovaris M, Bozzali M, et al. Assessment of normalappearing white and gray matter in patients with primary progressive multiple sclerosis: a diffusion-tensor magnetic resonance imaging study. Arch Neurol. 2002;59(9):1406–12
- Pulizzi A, Rovaris M, et al. Determinants of disability in multiple sclerosis at various disease stages: a multiparametric magnetic resonance study. Arch Neurol. 2007;64(8):1163–8.
- Rovaris M, Gallo A, et al. Short-term accrual of gray matter pathology in patients with progressive multiple sclerosis: an in vivo study using diffusion tensor MRI. Neuroimage. 2005;24(4):1139–46.
- Rovaris M, Judica E, et al. Grey matter damage predicts the evolution of primary progressive multiple sclerosis at 5 years. Brain. 2006;129(Pt 10):2628–34.
- Oreja-Guevara C, Rovaris M, et al. Progressive gray matter damage in patients with relapsing-remitting multiple sclerosis: a longitudinal diffusion tensor magnetic resonance imaging study. Arch Neurol. 2005;62(4):578–84.
- Rovaris M, Judica E, et al. A 3-year diffusion tensor MRI study of grey matter damage progression during the earliest clinical stage of MS. J Neurol. 2008;255(8):1209–14.
- Rovaris M, Iannucci G, et al. Cognitive dysfunction in patients with mildly disabling relapsing-remitting multiple sclerosis: an exploratory study with diffusion tensor MR imaging. J Neurol Sci. 2002;195(2):103–9.
- Fabiano AJ, Sharma J, et al. Thalamic involvement in multiple sclerosis: a diffusion-weighted magnetic resonance imaging study. J Neuroimaging. 2003;13(4):307–14.
- Evangelou N, Konz D, et al. Regional axonal loss in the corpus callosum correlates with cerebral white matter lesion volume and distribution in multiple sclerosis. Brain. 2000;123(Pt 9):1845–9
- Poonawalla AH, Hasan KM, et al. Diffusion-tensor MR imaging of cortical lesions in multiple sclerosis: initial fi ndings. Radiology. 2008;246(3):880–6.
- Filippi M, Preziosa P, et al. Microstructural MR imaging of cortical lesion in multiple sclerosis. Mult Scler. 2013;19(4):418–26.
- Wheeler-Kingshott CA, Parker GJ, et al. ADC mapping of the human optic nerve: increased resolution, coverage, and reliability with CSF-suppressed ZOOM-EPI. Magn Reson Med. 2002;47(1):24–31.
- Hickman SJ, Wheeler-Kingshott CA, et al. Optic nerve diffusion measurement from diffusion-weighted imaging in optic neuritis. AJNR Am J Neuroradiol. 2005;26(4):951–6.
- Trip SA, Wheeler-Kingshott C, et al. Optic nerve diffusion tensor imaging in optic neuritis. Neuroimage. 2006;30(2):498–505.
- Smith SA, Williams ZR, et al. Diffusion tensor imaging of the optic nerve in multiple sclerosis: association with retinal damage and visual disability. AJNR Am J Neuroradiol. 2011;32(9):1662–8.
- Kolbe S, Chapman C, et al. Optic nerve diffusion changes and atrophy jointly predict visual dysfunction after optic neuritis. Neuroimage. 2009;45(3):679–86.
- Clark CA, Werring DJ, et al. Diffusion imaging of the spinal cord in vivo: estimation of the principal diffusivities and application to multiple sclerosis. Magn Reson Med. 2000;43(1):133–8.
- Agosta F, Benedetti B, et al. Quantifi cation of cervical cord pathology in primary progressive MS using diffusion tensor MRI. Neurology. 2005;64(4):631–5.
- Valsasina P, Rocca MA, et al. Mean diffusivity and fractional anisotropy histogram analysis of the cervical cord in MS patients. Neuroimage. 2005;26(3):822–8.
- Benedetti B, Valsasina P, et al. Grading cervical cord damage in neuromyelitis optica and MS by diffusion tensor MRI. Neurology. 2006;67(1):161–3.
- Agosta F, Filippi M. MRI of spinal cord in multiple sclerosis. J Neuroimaging. 2007;17 Suppl 1:46S–9S.
- Benedetti B, Rocca MA, et al. A diffusion tensor MRI study of cervical cord damage in benign and secondary progressive MS patients. J Neurol Neurosurg Psychiatry. 2010;81(1):26–30.
- Inglese M, Salvi F, et al. Magnetization transfer and diffusion tensor MR imaging of acute disseminated encephalomyelitis. AJNR Am J Neuroradiol. 2002;23(2):267–72.
- Holtmannspotter M, Inglese M, et al. A diffusion tensor MRI study of basal ganglia from patients with ADEM. J Neurol Sci. 2003;206(1):27–30.
- Jones DK, Lythgoe D, Horsfield MA, Simmons A, Williams SC, Markus HS. Characterization of white matter damage in ischemic leukoaraiosis with diffusion tensor MRI. Stroke 1999;30:393-397.
- Jang SH. The corticospinal tract from the viewpoint of brain rehabilitation. J Rehabil Med 2014;46:193-199.
- Jang SH. A review of diffusion tensor imaging studies on motor recovery mechanisms in stroke patients. NeuroRehabilitation 2011;28: 345-352.
- Kumar P, Kathuria P, Nair P, Prasad K. Prediction of upper limb motor recovery after subacute ischemic stroke using diffusion tensor imaging: a systematic review and meta-analysis. J Stroke 2016;18:50-59.
- Kumar P, Yadav AK, Misra S, Kumar A, Chakravarty K, Prasad K. Prediction of upper extremity motor recovery after subacute intracerebral hemorrhage through diffusion tensor imaging: a systematic review and meta-analysis. Neuroradiology 2016;58:1043-1050.
- Eliassen JC, Boespflug EL, Lamy M, Allendorfer J, Chu WJ, Szaflarski JP. Brain-mapping techniques for evaluating poststroke recovery and rehabilitation: a review. Top Stroke Rehabil 2008;15:427-450.
- Rickards T, Sterling C, Taub E, Perkins-Hu C, Gauthier L, Graham M, et al. Diffusion tensor imaging study of the response to constraint-induced movement therapy of children with hemiparetic cerebral palsy and adults with chronic stroke. Arch Phys Med Rehabil 2014;95:506-514.e1.
- Lazaridou A, Astrakas L, Mintzopoulos D, Khanicheh A, Singhal AB, Moskowitz MA, et al. Diffusion tensor and volumetric magnetic resonance imaging using an MR-compatible hand-induced robotic device suggests training-induced neuroplasticity in patients with chronic stroke. Int J Mol Med 2013;32:995-1000.
- Dick AS, Tremblay P. Beyond the arcuate fasciculus: consensus and controversy in the connectional anatomy of language. Brain 2012;135:3529-3550.
- Forkel SJ, Thiebaut de Schotten M, Dell’Acqua F, Kalra L, Murphy DG, Williams SC, et al. Anatomical predictors of aphasia recovery: a tractography study of bilateral perisylvian language networks. Brain 2014;137:2027-2039.
- Kim SH, Lee DG, You H, Son SM, Cho YW, Chang MC, et al. The clinical application of the arcuate fasciculus for stroke patients with aphasia: a diffusion tensor tractography study. NeuroRehabilitation 2011;29: 305-310.
- Jang SH. Diffusion tensor imaging studies on arcuate fasciculus in stroke patients: a review. Front Hum Neurosci 2013;7:749.
- Schlaug G, Marchina S, Norton A. Evidence for plasticity in whitematter tracts of patients with chronic Broca’s aphasia undergoing intenseintonation-based speech therapy. Ann N Y Acad Sci 2009;1169:385-394
- Geva S, Correia M, Warburton EA. Diffusion tensor imaging in the study of language and aphasia. Aphasiology 2011;25:543-558.
- Arfanakis K, Haughton VM, Carew JD, Rogers BP, Dempsey RJ, Meyerand ME. Diffusion tensor MR imaging in diffuse axonal injury. AJNR Am J Neuroradiol 2002;23:794-802.
- Strauss S, Hulkower M, Gulko E, Zampolin RL, Gutman D, Chitkara M, et al. Current clinical applications and future potential of diffusion tensor imaging in traumatic brain injury. Top Magn Reson Imaging 2015;24:353-362.
- Aoki Y, Inokuchi R. A voxel-based meta-analysis of diffusion tensor imaging in mild traumatic brain injury. Neurosci Biobehav Rev 2016; 66:119-126.
- Niogi SN, Mukherjee P. Diffusion tensor imaging of mild traumatic brain injury. J Head Trauma Rehabil 2010;25:241-255.
- Aoki Y, Inokuchi R, Gunshin M, Yahagi N, Suwa H. Diffusion tensor imaging studies of mild traumatic brain injury: a meta-analysis. J Neurol Neurosurg Psychiatry 2012;83:870-876.
- Kraus MF, Susmaras T, Caughlin BP, Walker CJ, Sweeney JA, Little DM. White matter integrity and cognition in chronic traumatic brain injury: a diffusion tensor imaging study. Brain 2007;130:2508-2519.
- Cohen Adad J, El Mendili MM, Lehericy S, Pradat PF, Blancho S, Benali H, et al. Demyelination and degeneration in the injured human spinal cord detected with diffusion and magnetization transfer MRI. Neuroimage 2011;55:1024-33.
- Mulcahey MJ, Samdani AF, Gaughan JP, Barakat N, Faro S, Shah P, et al. Diagnostic accuracy of diffusion tensor imaging for pediatric cervical spinal cord injury. Spinal Cord 2013;51:532-7.
- Petersen JA, Wilm BJ, von Meyenburg J, Schubert M, Seifert B, Dietz V, et al. Chronic cervical spinal cord injury: DTI correlates with clinical and electrophysiological measures. J Neurotrauma 2012;29:1556-66.
- Hendrix P, Griessenauer CJ, Cohen Adad J, Rajasekaran S, Cauley KA, Shoja MM, et al. Spinal diffusion tensor imaging: A comprehensive review with emphasis on spinal cord anatomy and clinical applications. Clin Anat 2015;28:88-95.
- Koskinen E, Brander A, Hakulinen U, Luoto T, Helminen M, Ylinen A, et al. Assessing the state of chronic spinal cord injury using diffusion tensor imaging. J Neurotrauma 2013;30:1587-95.
- Chang Y, Jung TD, Yoo DS, Hyun JK. Diffusion tensor imaging and fiber tractography of patients with cervical spinal cord injury. J Neurotrauma 2010;27:2033-40.
- Ellingson BM, Ulmer JL, Kurpad SN, Schmit BD. Diffusion tensor MR imaging in chronic spinal cord injury. AJNR Am J Neuroradiol 2008;29:1976-82.
- Cheran S, Shanmuganathan K, Zhuo J, Mirvis SE, Aarabi B, Alexander MT, et al. Correlation of MR diffusion tensor imaging parameters with ASIA motor scores in hemorrhagic and nonhemorrhagic acute spinal cord injury. J Neurotrauma 2011;28:1881-92.
- Kamble RB, Venkataramana NK, Naik AL, Rao SV. Diffusion tensor imaging in spinal cord injury. Indian J Radiol Imaging 2011;21:221-4.
- Ellingson BM, Ulmer JL, Schmit BD. Morphology and morphometry of human chronic spinal cord injury using diffusion tensor imaging and fuzzy logic. Ann Biomed Eng 2008;36:224-36.
- Vedantam A, Eckardt G, Wang MC, Schmit BD, Kurpad SN. Clinical correlates of high cervical fractional anisotropy in acute cervical spinal cord injury. World Neurosurg 2015;83:824-8.
- Kelley BJ, Harel NY, Kim CY, Papademetris X, Coman D, Wang X, et al. Diffusion tensor imaging as a predictor of locomotor function after experimental spinal cord injury and recovery. J Neurotrauma 2014;31:1362-73.
- Vargas MI, Delavelle J, Jlassi H, Rillet B, Viallon M, Becker CD, et al. Clinical applications of diffusion tensor tractography of the spinal cord. Neuroradiology 2008;50:25-9.
- Landi A, Palmarini V, D'Elia A, Marotta N, Salvati M, Santoro A, et al. Magnetic resonance diffusion tensor imaging and fiber-tracking diffusion tensor tractography in the management of spinal astrocytomas. World J Clin Cases 2016;4:1-4.
- Ducreux D, Lepeintre JF, Fillard P, Loureiro C, Tadie M, Lasjaunias P. MR diffusion tensor imaging and fiber tracking in 5 spinal cord astrocytomas. AJNR Am J Neuroradiol 2006;27:214-6
- Ducreux D, Fillard P, Facon D, Ozanne A, Lepeintre JF, Renoux J, et al. Diffusion tensor magnetic resonance imaging and fiber tracking in spinal cord lesions: Current and future indications. Neuroimaging Clin N Am 2007;17:137-47.
- Lerner A, Mogensen MA, Kim PE, Shiroishi MS, Hwang DH, Law M. Clinical applications of diffusion tensor imaging. World Neurosurg 2014;82:96-109.
- Baron EM, Young WF. Cervical spondylotic myelopathy: A brief review of its pathophysiology, clinical course, and diagnosis. Neurosurgery 2007;60:S35-41.
- Furlan JC, Kalsi Ryan S, Kailaya Vasan A, Massicotte EM, Fehlings MG. Functional and clinical outcomes following surgical treatment in patients with cervical spondylotic myelopathy: A prospective study of 81 cases. J Neurosurg Spine 2011;14:348-55.
- Matsumoto M, Toyama Y, Ishikawa M, Chiba K, Suzuki N, Fujimura Y. Increased signal intensity of the spinal cord on magnetic resonance images in cervical compressive myelopathy. Does it predict the outcome of conservative treatment? Spine (Phila Pa 1976) 2000;25:677-82.
- Demir A, Ries M, Moonen CT, Vital JM, Dehasis J, Arne P, et al. Diffusion-weighted MR imaging with apparent diffusion coefficient and apparent diffusion tensor maps in cervical spondylotic myelopathy. Radiology 2003;229:37-43
- Song T, Chen WJ, Yang B, Zhao HP, Huang JW, Cai MJ, et al. Diffusion tensor imaging in the cervical spinal cord. Eur Spine J 2011;20:422-8.
- Kara B, Celik A, Karadereler S, Ulusoy L, Onat L, Mutlu A, et al. The role of DTI in early detection of cervical spondylotic myelopathy: A preliminary study with 3-T MRI. Neuroradiology 2011;53:609-16.
- Lee JW, Kim JH, Park JB, Park KW, Yeom JS, Lee GY, et al. Diffusion tensor imaging and fiber tractography in cervical compressive myelopathy: Preliminary results. Skeletal Radiol 2011;40:1543-51
- Mamata H, Jolesz FA, Maier SE. Apparent diffusion coefficient and fractional anisotropy in spinal cord: Age and cervical spondylosis-related changes. J Magn Reson Imaging 2005;22:38-43.
- Guan X, Fan G, Wu X, Gu G, Gu X, Zhang H, et al. Diffusion tensor imaging studies of cervical spondylotic myelopathy: A systemic review and meta-analysis. PLoS One 2015;10:e0117707.
- Rajasekaran S, Yerramshetty JS, Chittode VS, Kanna RM, Balamurali G, Shetty AP. The assessment of neuronal status in normal and cervical spondylotic myelopathy using diffusion tensor imaging. Spine (Phila Pa 1976) 2014;39:1183-9.
- Chen X, Kong C, Feng S, Guan H, Yu Z, Cui L, et al. Magnetic resonance diffusion tensor imaging of cervical spinal cord and lumbosacral enlargement in patients with cervical spondylotic myelopathy. J Magn Reson Imaging 2016;43:1484-91.
- Toktas ZO, Tanrikulu B, Koban O, Kilic T, Konya D. Diffusion tensor imaging of cervical spinal cord: A quantitative diagnostic tool in cervical spondylotic myelopathy. J Craniovertebr Junction Spine 2016;7:26-30
- Kerkovsky M, Bednarik J, Dusek L, Sprlakova-Pukova A, Urbanek I, Mechl M, et al. Magnetic resonance diffusion tensor imaging in patients with cervical spondylotic spinal cord compression: Correlations between clinical and electrophysiological findings. Spine (Phila Pa 1976) 2012;37:48-56.
- Ahmadli U, Ulrich NH, Yuqiang Y, Nanz D, Sarnthein J, Kollias SS. Early detection of cervical spondylotic myelopathy using diffusion tensor imaging: Experiences in 1.5-tesla magnetic resonance imaging. Neuroradiol J 2015;28:508-14.
- Jones J, Lerner A, Kim PE, Law M, Hsieh PC. Diffusion tensor imaging in the assessment of ossification of the posterior longitudinal ligament: A report on preliminary results in 3 cases and review of the literature. Neurosurg Focus 2011;30:E14.
- Wen CY, Cui JL, Mak KC, Luk KD, Hu Y. Diffusion tensor imaging of somatosensory tract in cervical spondylotic myelopathy and its link with electrophysiological evaluation. Spine J 2014;14:1493-500.