Klinička protonska MR Spektroskopija - primena u bolestima centralnog nervnog sistema
vanredni profesor dr sc. Jelena Ostojić medicinski fizičar specijalista
Protonska magnetnorezonantna (MR) spektroskopija (MRS) je jedna od naprednih MR imidžing tehnika, koristi se za neinvazivnu analizu metabolizma u tkivima. Najviše se primenjuje za procenu i interpretaciju promena metabolizma u centralnom nervnom sistemu, u različitoj intrakranijalnoj patologiji, kao što su tumori, multipla skleroza, ishemija, infekcije, epilepsija, metaboličke i nasledne bolesti mozga, i traumatske povrede. Klinička primena MR spektroskopije se stalno proširuje, tako da sada uključuje dojku, prostatu, štitastu žlezdu itd. (1-4). MRS se radi kao dodatna sekvenca uz rutinski MRI i daje dopunske informacije o metabolizmu i funkciji tkiva. Daje doprinos dijagnozi, uspešnijem lečenju, praćenju terapijskog odgovora posebno kod tumora mozga, i pomaže da se ostvari najbolji mogući ishod za pacijenta. Dijagnoza neuroloških bolesti je često kompleksna, vreme za efikasnu terapiju može biti ograničeno. MR imidžing sa svojim odličnim mekotkivnim kontrastom je metoda izbora za detektovanje lezija mozga. I pored toga konvencionalni MRI ne može da detektuje promene u ćelijskoj gustini, tipu ćelija, ili biohemijskom sastavu- a sve ove informacije mogu da se dobiju primenom MR spektroskopije. Pored toga, lezije koje imaju različitu patofiziologiju često izgledaju isto na MRI morfološkim snimcima. Zbog toga je spektroskopija potrebna kao dopunska metoda, tj. MR imidžing i MR spektroskopija su komplementarne tehnike za dijagnostikovanje bolesti, praćenju progresije i odgovora na terapiju.
Neurološke bolesti kod kojih MR spektroskopija daje značajan doprinos donošenju kliničkih odluka
Tumori mozga
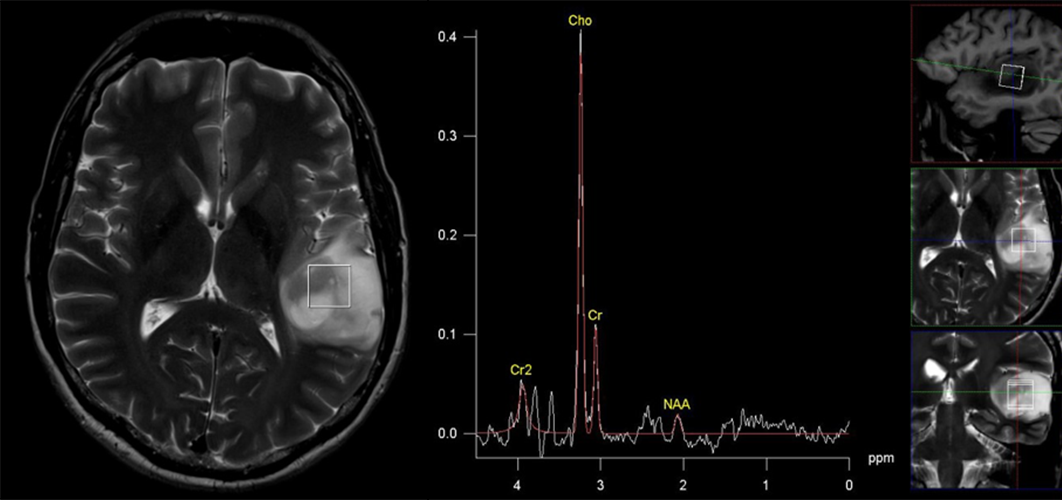
Kliničke odluke u neuroonkologiji donosi multidisciplinarni tim kombinovanjem informacija iz više izvora, uključujući MR imidžing. Iako MR imidžing ima centralnu ulogu u odlučivanju o terapiji za pacijente sa tumorima mozga, postoje važna klinička pitanja na koja ne daje odgovor. Tu se ubraja: razlikovanje tumora od drugih fokalnih lezija (velikog plaka demijelinizacije, encefalitisa, i drugih), postavljanje definitivne dijagnoze atipičnih fokalnih lezija koje se prstenasto boje (na primer, visokogradusnih glioma, metastaza i apscesa), identifikovanje optimalnog mesta za biopsiju kod heterogenih glioma, praćenje terapijskog odgovora i razlikovanje posledica terapije (postterapijska nekroza) od recidiva tumora. MR spektroskopija može da obezbedi dodatne informacije u svim ovim kliničkim dilemama i često se koristi kao dopunska metoda uz konvencionalni MR imidžing (5). Od početka primene MR spektroskopije je uočen veliki potencijal ove metode za neinvazivno ispitivanje neoplazije mozga. Na primer MR spektroskopija zajedno sa perfuzijom obezbeđuje senzitivnost 72% i specifičnost 92% u razlikovanju tumora od drugih lezija (6). Slično tome, postiže se senzitivnost 93% i specifičnost 60% kada se ove dve metode koriste za razlikovanje visokogradusnih od niskogradusnih glioma, što predstavlja suštinsko unapređenje u senzitivnosti i specifičnosti u odnosu na primenu samo konvencionalnog MRI (7). Velike multicentrične studije su odredile tačnost singl-voksel MR spektroskopije za dijagnostikovanje histologije i gradusa tumora mozga (8-10). Spektroskopija sa kratkim vremenom eha ima tačnost od 90% za razlikovanje tipova tumora (meningeomi, niskogradusni gliomi, glioblastom multiforme, metastaze), za razlikovanje glioblastoma multiforme od metastaze je preciznost 78% (8,10). Kombinovanje spektroskopije sa kratkim i dugim vremenom eha daje visoku dijagnostičku preciznost 98% za tipove tumora koji se najčešće javljaju kod dece (pilocitični astrocitom, meduloblastom i ependimom) (9). Spektroskopija može da pomogne i u razlikovanju molekularnih podtipova glioma sa mutacijom izocitrat dehidrogenaze (vidi se pik izocitrat dehidrogenaze na spektru). Na ovaj način se određuje genetika tumora in vivo na bazi prisustva 2-hidroksiglutarata (11). Prisustvo metilacije tj. prisustvo 2-hidroksiglutarata na spektru predviđa povoljan odgovor na terapiju kod glioma. Kada su vršena poređenja dijagnostičke tačnosti MR spektroskopije i konvencionalnog MR imidžinga u multicentričnim studijama spektroskopija je značajno poboljšala preciznost dijagnoze nisko- i visokogradusnih tumora (12). Povišen holin (Cho) i snižen N-acetilaspartat (NAA) su tipične spektroskopske odlike tumora mozga (13) (Slika 1). Pored toga, prisustvo signala na oko 1.3 ppm, koji potiču od lipida i laktata su znak nekroze ili hipoksije, što se povezuje sa višim gradusom i lošijom prognozom (14-16) (Fig 2). Suprotno tome, lezije netumorske prirode kao što su apscesi i tuberkulomi imaju sasvim drugačije spektre, bez porasta holina, sa pojavom brojnih aminokiselina (17). Drugi metaboliti koji se registruju kod tumora mozga su: taurin kod primitivnog neuroektodermalnog tumora (18), alanin kod meningeoma (13), i glicin kod visokogradusnih tumora kod dece (19).
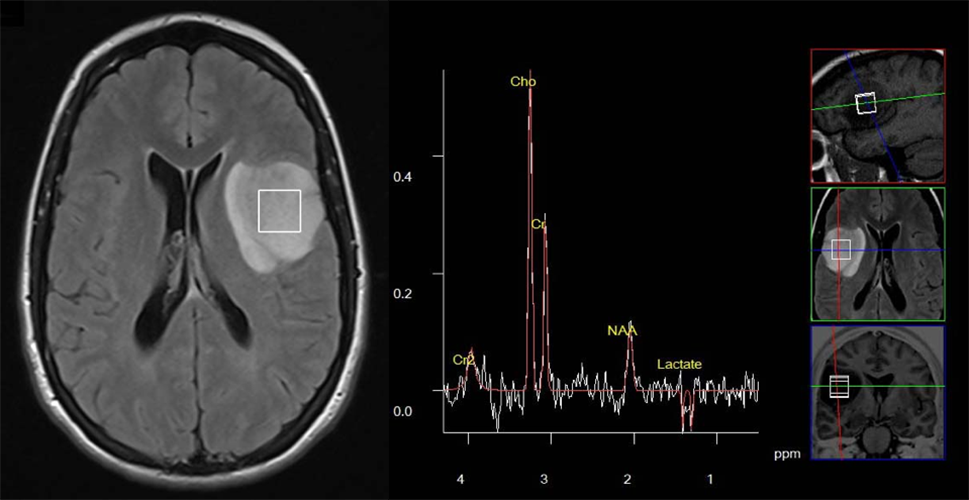
Slika 1. Prikazan je tipičan spektar glijalnog tumora: pik holina je povišen u odnosu na kreatin, a N-acetilaspartat je snižen. Prisutan je dublet laktata.
Spektroskoija može da pomogne kod razlikovanja glijalnih od neglijalnih tumora. Dešava se da neglijalni i ekstraaksijalni tumori na primer meningeom izgledaju infiltrativno na MRI (Slika 2). U ovakvim situacijama spektroskopija potpuno menja dijagnozu i lečenje.
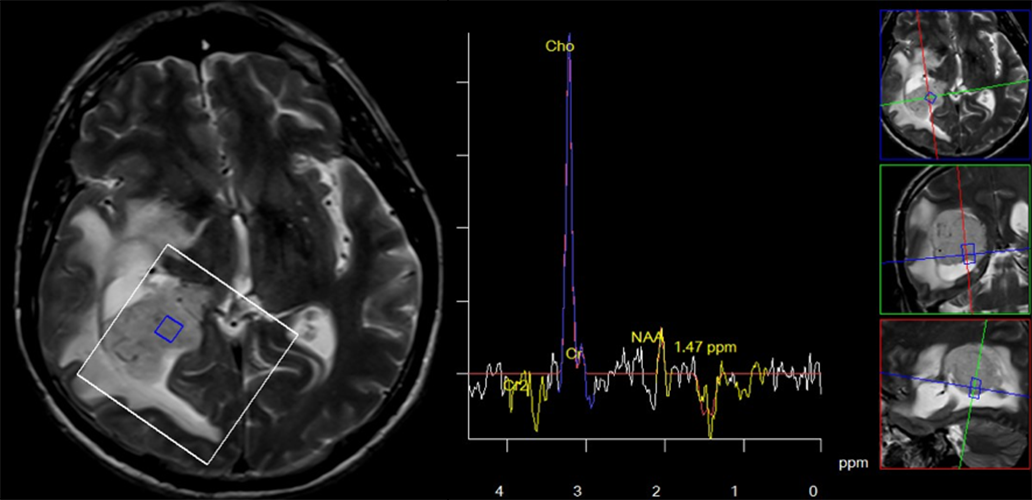
Slika 2. Intraventrikularni meningeom. Neglijalni tumori imaju drugačije spektre od glijalnih. Za tumor koji je prikazan na slici se pre pregleda spektroskopijom smatralo da je glioblastom multiforme. Spektroskopijom smo utvrdili da se radi o meningeomu, što je potvrđeno posle operacije.
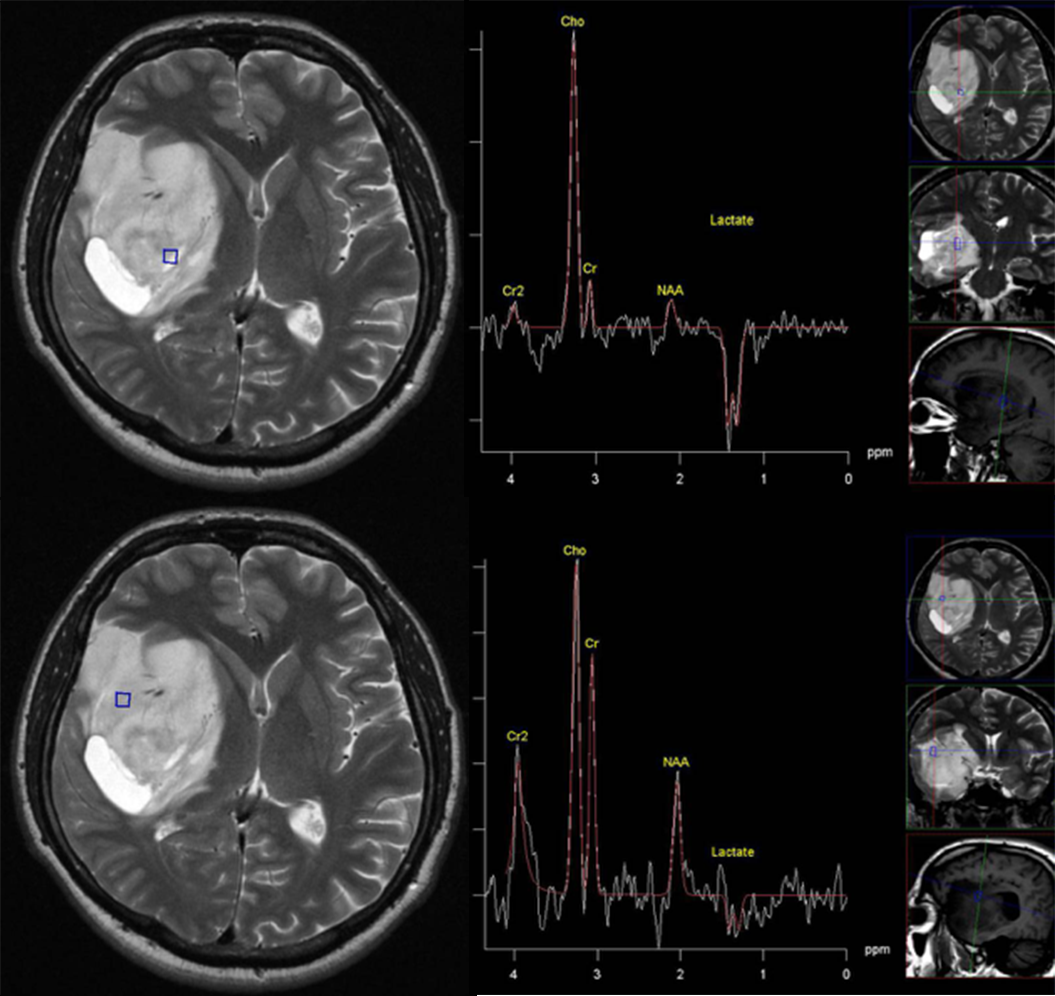
Slika 3. Trodimenzionalne tehnike spektroskopije omogućavaju da se ispita prostorna raspodela koncentracija metabolita u celom tumoru i da se utvrde mesta sa najvećim stepenom malignosti. Spektri pojedinih zona u prikazanom tumoru se značajno razlikuju. Na taj način možemo da definišemo lokacije u tumoru sa najvećim stepenom malignosti i da precizno utvrdimo gradus.
Spektroskopija može da definiše zonu u tumoru sa najvećim stepenom malignosti i da sugeriše lokacije za biopsiju (20,21) (Slika 3). Detektovanje povišenog holina u peritumorkoj regiji pokazuje infiltrativnost tumora i može da se koristi za razlikovanje visokogradusnih glioma od metastaza mozga (spektar je normalan ili sa veoma malim odstupanjima u tkivu koje okružuje metastazu) (22,23). MR spektroskopija često ima odlučujuću ulogu u razlikovanju niskogradusnih od visokogradusnih tumora kao i u razlikovanju visokogradusnih tumora od metastaza (Slika 4). Najčešće se koristi kao deo dijagnostičkog algoritma uz konvencionalni MRI sa gadolinijumom, difuzijom i perfuzijom (24).
Slika 4. Ilustruje mogućnosti spektroskopije u razlikovanju glijalnih tumora od drugih lezija koje mogu da izgledaju slično na konvencionalnom MRI. Prve dve slike prikazuju T2 i postkontrastni MR imidž lezije koja po morfološkim odlikama više liči na metastazu ili infekciju. Na trećoj i četrvrtoj slici su dati rezultati spektroskopije koji su karakteristični za visokogradusni glijalni tumor što je potvrđeno posle operacije.
MR spektroskopija može da odredi prognozu i da vodi planiranje terapije kod onkoloških bolesnika kod kojih se ne sprovodi hirurško lečenje, na primer kod difuznih glioma moždanog stabla i intramedularnih tumora kičmene moždine (25). Utvrđeno je da odnos amplituda pikova Cho/NAA od minimalno 2.1 (vreme eha TE od 144 ili 270) znači lošu prognozu kod pedijatrijskih difuznih pontinih glioma (26).
Slika 5. Na prvoj slici je prikazana pozicija voksela za spektroskopiju na T2 imidžu. Tumor koji smo ispitivali spektroskopijom nije pokazivao znake postkontrastnog bojenja pa je na MRI pregledu koji je prethodio prikazanoj spektroskopiji, opisan kao niskogradusni. Rezultat spektroskopije prikazan na drugoj slici odgovara infiltrativnom tumoru gr III, što je i potvrđeno biopsijom.
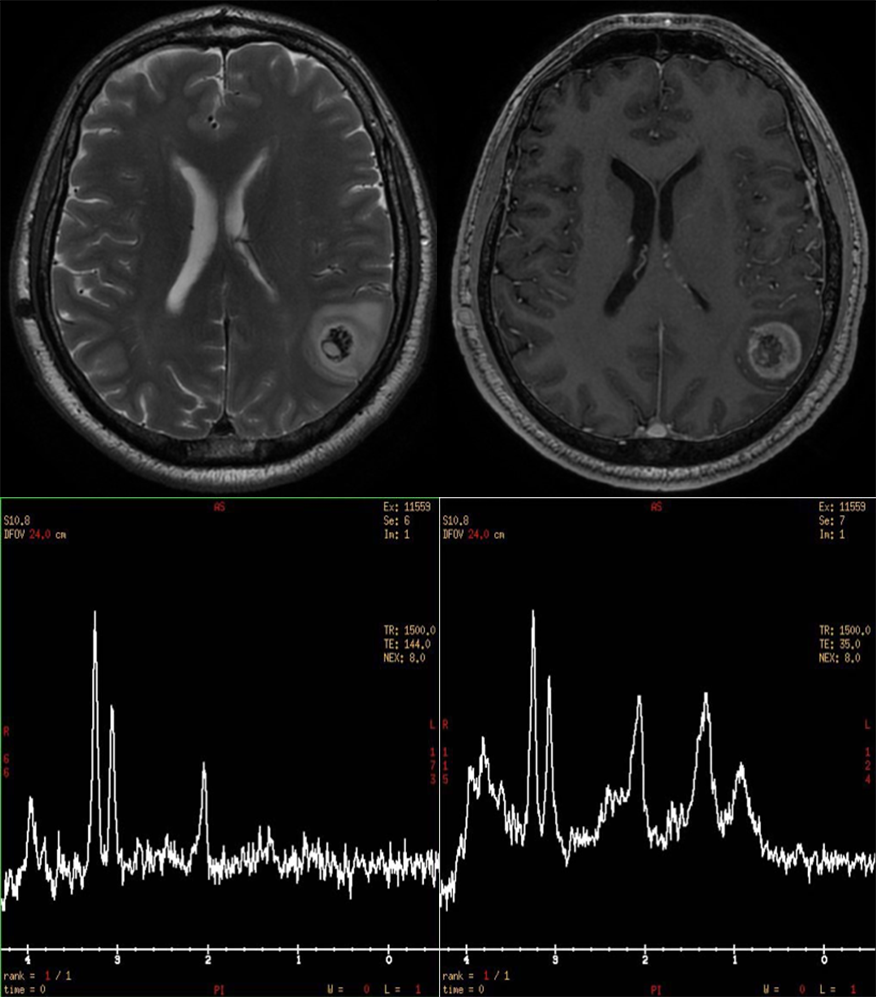
Prognostički markeri koje obezbeđuje MR spektroskopija su važni u odlučivanju za terapijski pristup jer mogu da pomognu da se identifikuju pacijenti kojima je potreban intenzivniji tretman (11,27,28). Brojna vrednost odnosa holina i N-acetilaspartata Cho/NAA veća od 2.1 na spektroskopskom imidžingu ili tzv. multi-voksel spektroskopiji se koristi za identifikovanje regija agresivnijeg fenotipa unutar heterogenih glioblastoma multiforme, što unapređuje radiohirurgiju gama nožem (29). Spektroskopija može da pomogne u planiranju neurohirurškog lečenja tako što određuje granice tumora i zajedno sa drugim MR imidžing metodama, u utvrđivanju odnosa sa okolnim moždanim strukturama (21). Infiltrativni gliomi se prostiru izvan granica koje definišu T2 imidži. Zona infiltracije koju utvrđuje spektroskopija je u proseku 24% veća od zone T2 hiperintenziteta i potvrđena je podudarnost povišenog Cho/NAA odnosa sa rezultatima histoloških i imunohistohemijskih analiza (30). Registrovan je povišen mioinozitol (mI) i glutamin (Gln) u kontralateralnoj hemisferi kod osoba sa nelečenim glioblastomom multiforme, što govori o ranoj neoplastičkoj infiltraciji (31). Pored toga, tumori svih gradusa mogu da budu heterogeni (32), i kada imaju homogene imidžing karakteristike. Često spektroskopija utvrdi niskogradusni oligodendrogliom i pored malignih karakteristika na konvencionalnom MRI. Ili suprotno tome, za tumore koji se ne boje na kontrast i imaju benigne karakteristike na konvencionalnom MRI, spektroskopijom se utvrdi da se radi o visokom gradusu (Slika 5). Kod niskogradusnih tumora je važno detektovanje zona infiltracije izvan granica lezije vidljive na konvencionalnom MRI jer su to primarne zone u kojima se pojavljuje recidiv. Dokazano je da rezultati MR spektroskopije odgovaraju histološkom tipu i gradusu i da mogu da definišu prostornu heterogenost tumora mozga pre hirurgije (Slika 3) (21). Upotreba MR spektroskopije može da pomoge da ne dođe do pogrešne procene progresije tumora, što može da dovede do neadekvatne hirurgije u slučajevima postterapijske nekroze koju je često nemoguće razlikovati od recidiva ako se koristi samo MRI (Slika 6).
Na slici 6 je dat postkontrastni T1 imidž posle operacije visokogradusnog tumora i hemo-radio terapije. I pored postkontrastnog bojenja, vidimo tipičnu spektroskopsku sliku postterapijske sekvele.
Odnos pikova holina i N-acetilaspartata (Cho/NAA) na spektru najpouzdanije razlikuje recidiv glioma od postterapijskih sekvela (33).
Slično tome, praćenje promena pika holina, u kombinaciji sa konvencionalnim MRI može dalje da doprinese praćenju terapijskog odgovora (34). MR spektroskopija (odnos NAA/Cho i koncentracija Cho) u kombinaciji sa perfuzijom ima pozitivnu prediktivnu vrednost 100% za razlikovanje postterapijskih promena od recidiva tumora, dok je pozitivna prediktivna vrednost konvencionalnog MRI 50%, a pozitronska emisiona tomografija (PET) sa fluordezoksiglukozom (PET) ima pozitivnu prediktivnu vrednost 67% (35).
MR spektroskopija, kao dodatak MR imidžingu daje značajan doprinos dijagnozi i prognozi, planiranju terapije i praćenju tumora mozga.
Pedijatrijski poremećaji: Nasledne bolesti metabolizma i traumatska povreda mozga
MR spektroskopija se od samih početaka primene (36-38) koristi u pedijatrijskom imidžingu mozga i radi se kao deo rutinskih imidžing protokola u mnogim dečijim bolnicama.
U ovom tekstu neću govoriti o ulozi MR spektroskopije u hipoksijii-ishemiji kod novorođenih beba zbog složenosti anestezije u magnetnoj rezonanci.
Nasledne metaboličke bolesti, iako veoma retke su značajan entitet u neuropedijatriji.
Klinički simptomi u određenim naslednim bolestima metabolizma nastaju kao posledica nakupljanja metabolita koji su neurotoksični ili utiču na normalnu funkciju. Prisustvo ili porast te supstance se koristi za dijagnozu, ako je supstanca koja se akumulira vidljiva MR spektroskopijom. MR spektroskopija se pokazala kao klinički korisna metoda kod dece sa sumnjom na metabolički poremećaj (39–41) zbog jedinstvene mogućnosti da neinvazivno detektuje metabolički defekt in vivo (42–45). Na primer, prisustvo piruvata (plus laktat i/ili alanin) i sukcinata su rani indikatori kompleksnih poremećaja piruvat i sukcinat dehidrogenaze (39,46–48). Detekcija povišenog glicina ukazuje na neketotičku hiperglicinemiju (42). Značajno povišen N-acetilaspartat je znak Kanavanove bolesti (49). Kod drugih naslednih bolesti MR spektroskopija može da detektuje pad koncentracija metabolita do kog dolazi zbog redukcije sinteze ili transporta (Slika 7). Odsutan ili značajno snižen kreatin (Cr) u mozgu predstavlja diferencijalnu dijagnozu nekoliko genetskih poremećaja (50): najniži nivo kreatina je izmeren kod dece sa defektom sinteze kreatina (guanidinoacetate methyltransferase deficiency), terapija normalizuje kreatin u mozgu (51,52).
Slika 7. Patološka spektroskopija u beloj masi koja izgleda zdravo kod osobe sa genetski potvrđenom bolesti mitohondrija (Leberova hereditarna optička neuropatija). Konvencionalni MR imidžing je bio potpuno uredan. Slika je iz publikacije: Ostojic J, Jancic J, Kozic D, Semnic R, Koprivsek K, Prvulovic M, Kostic V. Brain white matter 1 H MRS in Leber optic neuropathy mutation carriers. Acta Neurol. Belg. 2009; 109:305-309.
Kod muškaraca sa poremećajem transporta kreatina su koncentracije kreatina u mozgu snižene 4-5 puta u odnosu na koncentracije kod zdravih dobrovoljaca. Kod ovih pacijenata terapija kreatinom ne dovodi do poboljšanja (53, 54). Opisano je i potpuno odsustvo N-acetilaspartata zbog poremećaja sinteze (55, 56). Tokom razvoja dolazi do promena u koncentracijama metabolita mozga (57), tako da je neophodno poznavati normalne opsege koncentracija metabolita za određeni uzrast. Sa ovim pristupom mogu da se utvrde i blaža biohemijska odstupanja i tako dijagnostikuje Mukopolisaharidoza (58), i propionska acidemija (59).
MR spektroskopija može da predvidi ishod kod traumatske povrede mozga (čak i kod dece koja su u komi) (60). Može precizno da napravi razliku između dobrog i lošeg ishoda u nesrećama u kojima skoro nastupa davljenje (61).
Demijelinizacione bolesti
MR spektroskopija igra važnu ulogu u diferencijalnoj dijagnozi naslednih leukoencefalopatija, sama (62) ili zajedno sa drugim naprednim tehnikama magnetne rezonance (63).
Spektroskopija obezbeđuje važne podatke o patofiziologiji tkiva. To su informacije o:
(a) hipomijelinaciji, (b) razređenju bele mase, i (c) demijelinizaciji, ove pojave se razlikuju na bazi odnosa metabolita Cho/Cr i tNAA/Cr (62). Hematopoetska transplantacija matičnih ćelija je trenutno jedina terapijska opcija za nasledne demijelinizacione bolesti kao što je X-vezana adrenoleukodistrofija, metahromatska leukodistrofija, i globoidna leukodistrofija (64).
MR spektroskopija se koristi za praćenje pojave demijelinizacije kod neurološki asimptomatskih pacijenata sa X-vezanom adrenoleukodistrofijom (65,66). Intervalni porast mioinozitola i holina na spektru (mI/NAA, Cho/NAA) u beloj masi koja izgleda zdravo na konvencionalnoj magnetnoj rezonanci su indikacija za terapiju hematopoetske transplantacije matičnih ćelija. Do stabilizacije dolazi ako se ova terapija primeni pre značajne degeneracije tkiva (što se procenjuje na osnovu koncentracije NAA) (67). Kod novodijagnostikovanih pacijenata sa juvenilnom ili metahromatskom leukodistrofijom odraslih, kombinovanjem MR imidžinga i MR spektroskopije može da se proceni status inflamacije moždanog tkiva (68,69). Mioinozitol (mI) je povišen čak i u ranim stadijumima metahromatske leukodistrofije, ali dokle god je koncentracija N-acetilaspartata u normalnom opsegu, hematopoetska transplantacija matičnih ćelija je indikovana (70,71).
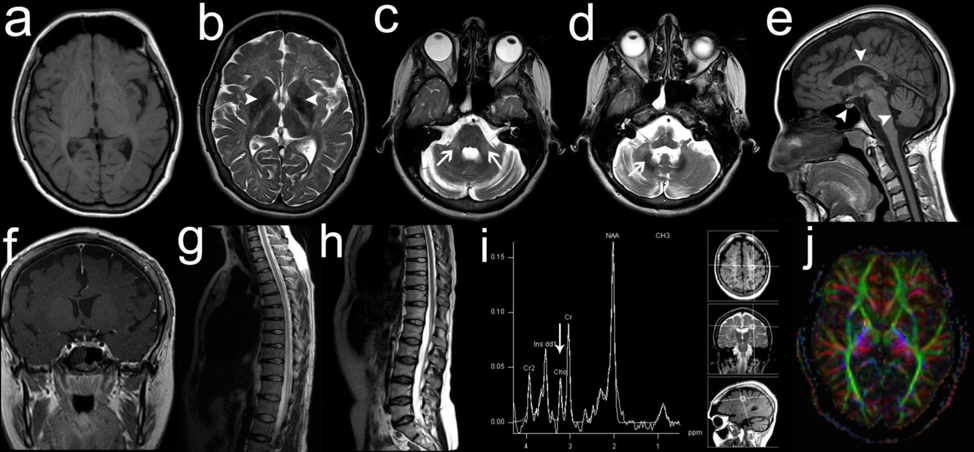
Slika 8. Multiparametrijski pristup kod pacijenta sa leukodistrofijom. (a) T1 aksijalni snimak mozga koji prikazuje hipomijelinaciju (b) T2 vidi se hipointenzitet globusa palidusa (c) T2, zahvatanje srednjeg cerebelarnog pedunkla; (d) T2 hipointenzitet nukleusa dentatusa (e) T1 sagitalni presek: atrofija cerebeluma, moždanog stabla, korpusa kalozuma (f) koronalni T1 sa kontrastom vidi se mala adenohipofiza (g) Snižen odnos holina prema kreatinu na MR spektru; (h) Difuzioni tenzorski imidžing potvrđuje hipomijelinizaciju (i, j) normalni snimci kičme. Slika je iz publikacije doktorke Ane Potić sa Klinike za dečiju neurologiju u Beogradu: Potic A, Popovic V, Ostojic J, Pekic S, Kozic D, Guerrero K, Schiffmann R, Bernard G. Neurogenic bladder and neuroendocrine abnormalities in Pol III-related leukodystrophy. BMC Neurol. 2015 Mar 4;15:22. doi: 10.1186/s12883-015-0283-7.
Klinička primena MR spektroskopije kod multiple skleroze se odnosi pre svega na doprinos razlikovanju multiple skleroze i demijelinizacije u širem smislu od drugih lezija. Na primer tumefaktivni plak se primenom konvencionalnog MRI u nekim situacijama teško razlikuje od tumora, ponekad postoji dilema da li su lezije demijelinizacione ili vaskularne prirode itd. U takvim kliničkim situacijama, spektroskopija kao dopuna MR imidžingu povećava specifičnost pregleda i olakšava dijagnozu (Slika 9).
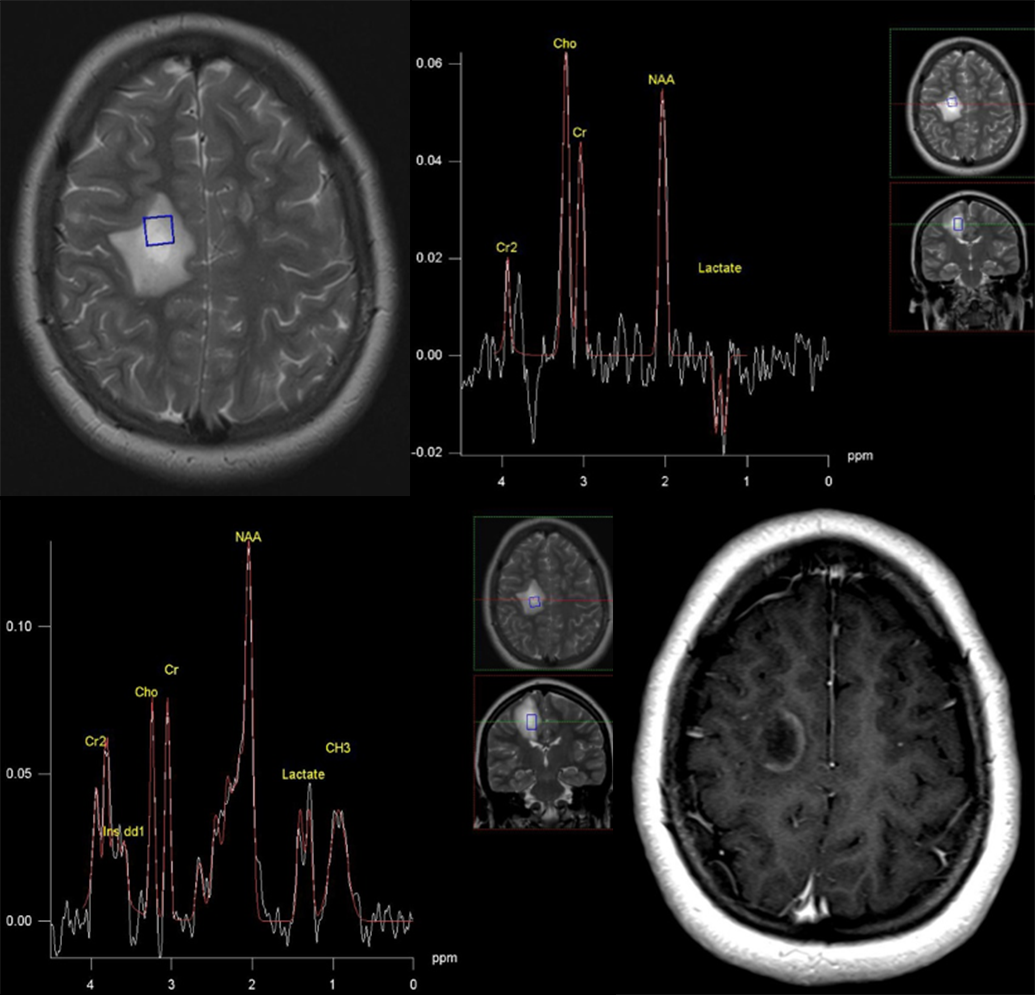
Slika 9. Prikazuje primenu spektroskopije u razlikovanju demijelinizacije od ostalih lezija. Ako postoji samo jedan veći plak, može da postoji dijagnostička dilema. Na prvoj slici je T2 imidž na kom je postavljen voksel za spektroskopiju. Spektri isključuju neoplaziju kao diferencijalno dijagnostičku mogućnost. U prilog demijelinizacije govori i način na koji se lezija boji (četvrta slika).
MR spektroskopija hroničnih plakova multiple skleroze u beloj masi pokazuje konzistentno snižen odnos NAA/tCr (72,73) i ponekad povišen Cho/Cr (73). Spektri plakova koji su u fazi aktivne inflamacije pokazuju povišen odnos Cho/Cr, normalan ili snižen NAA/Cr (73), i povišene signale makromolekula koji nastaju iz produkata raspada mijelina (74). Odnos NAA/Cr u beloj masi koja izgleda zdravo na konvencionalnom MRI kod pacijenata sa kliničkom prezentacijom koja varira može da napravi razliku između osoba koje imaju multiplu sklerozu i zdravih ispitanika (75,76). Ovaj biohemijski parametar je u inverznoj korelaciji sa stepenom onesposobljenosti (77). Pored toga, odnos Cho/Cr je povišen u beloj masi koja izgleda zdravo mesecima pre nego što lezije postanu vidljive na konvencionalnom MRI (78, 79). MR spektroskopija igra važnu ulogu i u razlikovanju multiple skleroze od akutnog diseminiranog encefalomijelitisa (ADEM), gde dolazi do oporavka NAA što je znak dobre prognoze.
Infekcije mozga
Infekcije mozga mogu da ugroze život, zato je rana dijagnoza neophodna za optimalno lečenje. Definitivni laboratorijski dijagnostički testovi mogu da budu dugotrajni što odlaže terapiju.
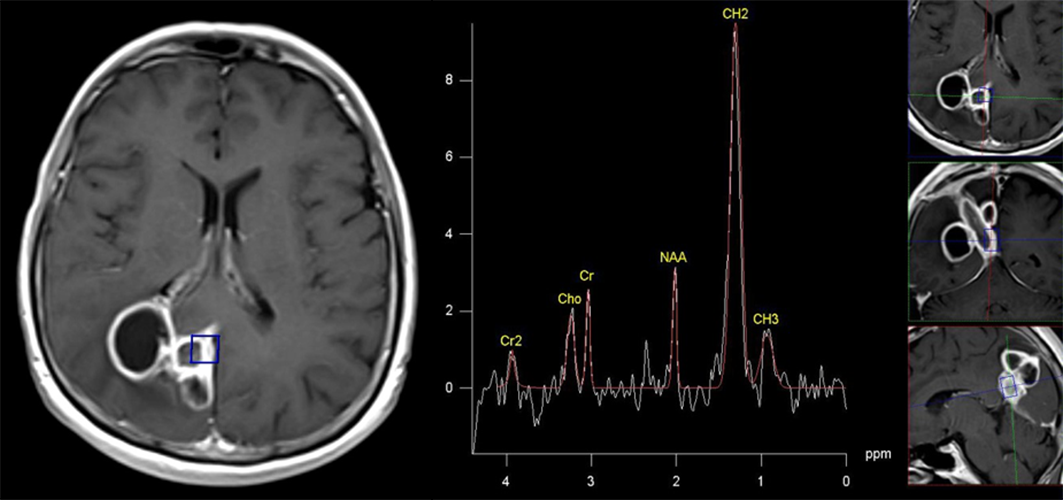
MR spektroskopija daje doprinos diferencijalnoj dijagnozi intrakranijalnih lezija koje se prstenasto boje. Kada se pojavi takva lezija sa nespecifičnim kliničkim karakteristikama i nespecifičnim konvencionalnim MR imidžingom, spektroskopija može da potvrdi ili eliminiše dijagnozu piogenog apscesa i da obezbedi informacije o tipu uzročnika infekcije (80,81). Apsces ima karakterističan spektar koji je potpuno drugačiji od spektra tumora i lako se razlikuje (Slika 10).
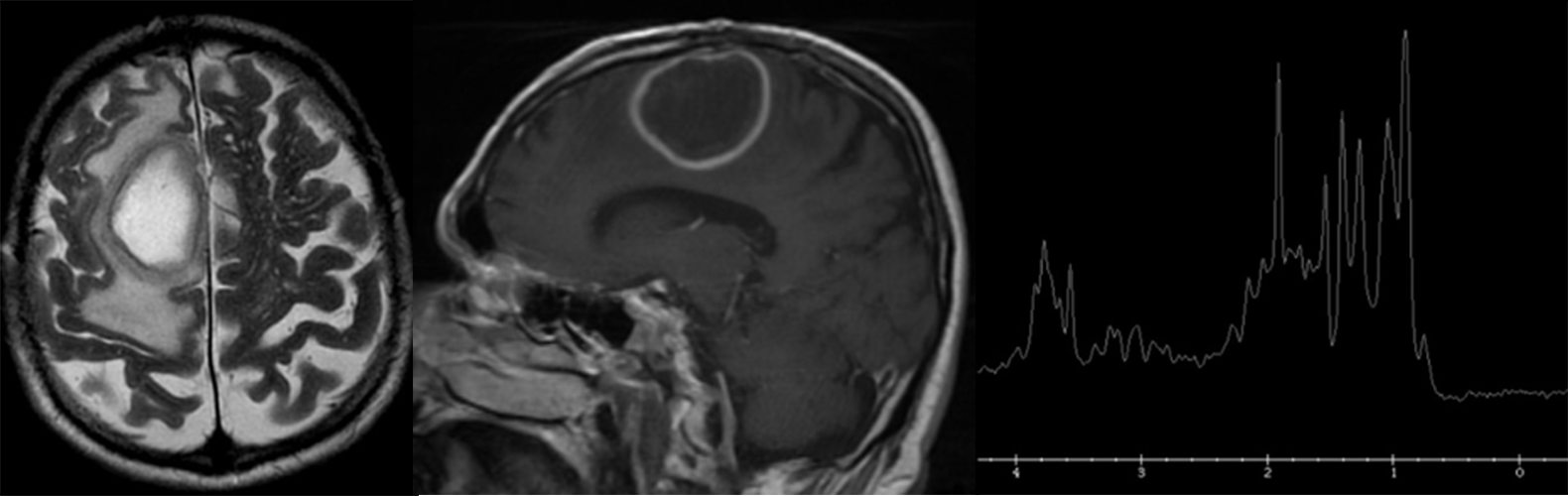
Slika 10. U nekim kliničkim situacijama je nemoguće razlikovati apsces od tumora ili metastaze. Spektroskopija daje značajan doprinos u razrešavanju ove kliničke dileme. Na slikama su prikazani T2 i T1 postkontrastni imidž apscesa, zatim spektar koji je potpuno drugačiji od spektara tumora i metastaza.
Pojava sukcinata, acetata, alanina, leucina, izoleucina, je specifična za piogeni apsces-čak i u odsustvu restrikcije difuzije na MR imidžingu. Ciste koje uzrokuju paraziti sadrže sukcinat i acetat, uz odsustvo amino kiselina, što omogućava njihovo razlikovanje od anaerobnih apscesa (81,82). MR spektroskopija pomaže u razlikovanju tuberkuloma od drugih lezija koje slično izgledaju na konvencionalnom MR imidžingu. MR spektroskopija apscesa uzrokovanog tuberkulozom pokazuje samo signale laktata i lipida, nema aminokiselina (80). Možemo da zaključimo da MR spektroskopija igra važnu ulogu u dijagnozi fokalnih moždanih infekcija.
Neurološke bolesti kod kojih MR spektroskopija može da da doprinos donošenju kliničkih odluka
Neurodegenerativne bolesti
Karakteristika neurodegenerativnih bolesti na MR spektru je pad koncentracije N-acetilaspartata (NAA), u regijama zahvaćenim degenetivnim procesom (83,84). Nivo NAA govori o težini bolesti (85) i korelira sa kliničkim parametrima (86,87). Odnos NAA/Cr je niži kod osoba sa blagim kognitivnim oštećenjem koji prelaze u demenciju u poređenju sa onima koji ostaju stabilni (88). Zbog toga je NAA/tCr odnos ili koncentracija NAA indikator prognoze bolesti (89). Druge promene koje nastaju u neurodegeneraciji su smanjen nivo glutamata (Glu) (87,90,91), povišen holin (Cho) (84), i povišen mioinozitol (mI) (91,92). Porast mioinozitola odražava glijalnu ili mikroglijalnu aktivaciju (93). Do porasta mioinozitola dolazi veoma rano kod demencije, pre pada koncentracije NAA, pre atrofije, gubitka neurona i kognitivnog oštećenja što je dokazano kod presimptomatskih nosilaca nasledne Alchajmerove bolesti (94) i kod pacijenata sa mutacijom za frontotemporalnu lobarnu degeneraciju (95). MR spektroskopija može da se koristi i za praćenje odgovora na terapiju u neurodegenerativnim bolestima.
Epilepsija
Od ukupnog broja osoba sa epilepsijom 60%–70% reaguje na lekove (96,97). Hirurška intervencija može da bude efikasna kod preostalih 30%–40% (98,99). Ishod hirurgije kod najčešćih tipova fokalne epilepsije se unapređuje ako može jasno da se definiše fokus epilepsije (98,99). Konvencionalni MR imidžing može precizno da lokalizuje fokus epilepsije ako postoji jednostrana atrofija hipokampusa ili malformacije kortikalnog razvoja. Ali imidžing je često negativan kod epilepsije ili dvosmislen, ponekad se lezije koje vidimo na MR imidžingu ne poklapaju sa fokusom epilepsije utvrđenim elektroencefalografskim metodama. Pored utvrđivanja fokusa epilepsije, MR spektroskopija se intenzivno koristi i za bolje razumevanje epilepsije zbog fiziološke povezanosti funkcije i metabolizma mozga (100, 101).
Koncentracija NAA i odnos NAA/tCr su korisni biomarkeri za utvrđivanje moždanih oštećenja do kojih dovode napadi epilepsije (101-105). Najčešći poremećaj kod epilepsije temporalnog lobusa je mezijalna temporalna skleroza, koja često može efikasno da se leči hirurški. Na slici 11 je prikazana spektroskopija hipokampusa. Multimodalni pristup koji uključuje elektroencefalografiju, konvencionalni MR imidžing, i PET metabolički imidžing se obično koriste za lateralizovanje epileptogene zone u slučaju mezijalne temporalne skleroze. Velika analiza koja je objedinila 22 studije MR spektroskopije od kojih su 19 izvedene na uređajima od 1.5-T pokazuje da istostrani biohemijski poremećaj registrovan MR spektroskopijom predviđa dobar ishod hirurgije (106). Sniženi parametri MR spektroskopije: NAA/Cr i NAA/(Cr + Cho) su najbolji pokazatelji epileptogene zone. Spektroskopija može da pomogne u donošenju odluka o hirurškom lečenju i kod pacijenata kod kojih nema MR vidljivih lezija i kod onih sa obostranim epileptogenim zonama ali se još uvek ne primenjuje na ovaj način u rutinskoj kliničkoj praksi (106). Koristi se i za analizu epilepsije kod dece, gde je koncentracija NAA pokazatelj statusa bolesti (107).
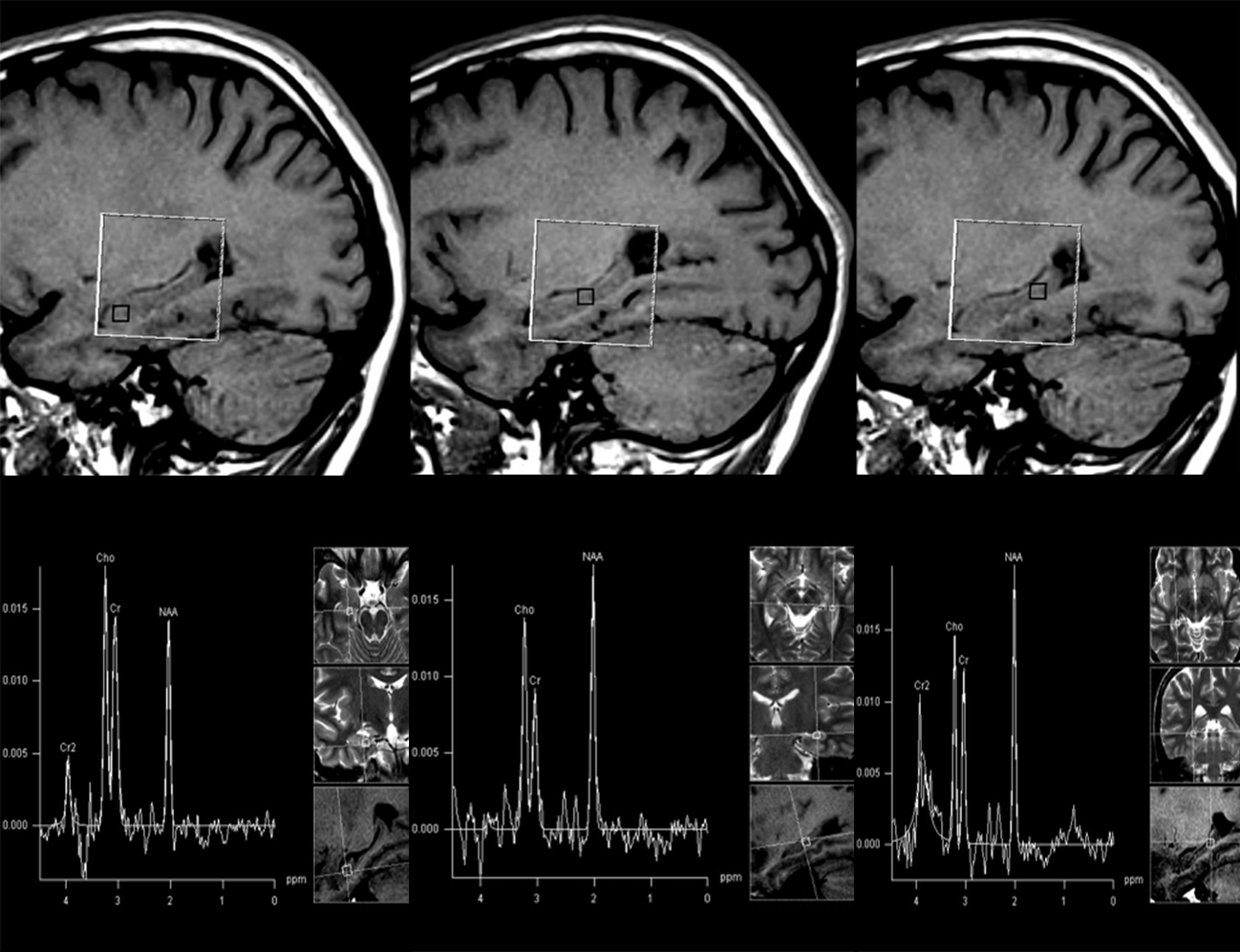
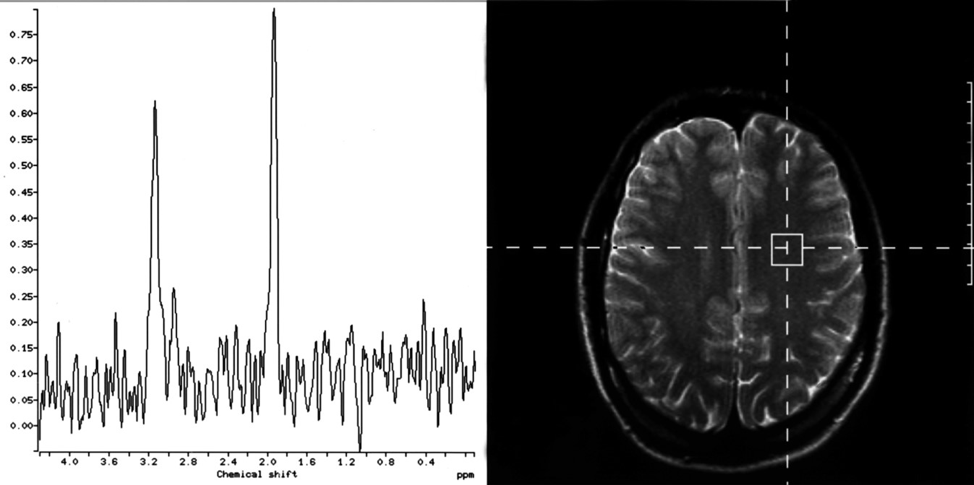
Slika 11. Spektroskopija hipokampusa snimljena trodimenzionalnom tehnikom kod zdravog dobrovoljca. Na ovaj način može da se ispita ceo hipokampus, prikazani su spektri snimljeni u glavi, telu i repu.
Ishemija
MR spektroskopija daje veliki doprinos razlikovanju ishemijskih od ostalih lezija. Na slici 12a su dati MR imidži bolesnika sa vaskularnim lezijama koje su praćene tokom dužeg vremenskog perioda. Pacijent je razvio kliničku sliku koja je najviše odgovarala akutnoj ishemiji, u urgentnom centru je nakon CT i kliničkog pregleda dobio dijagnozu akutnog ishemijskog moždanog udara. Lezija u frontalnom lobusu desne hemisfere na konvencionalnim MR imidžima takođe ima sve karakteristike akutne ishemije, međutim spektroskopija govori u prilog visokogradusnog tumora. Na kontrolnom MRI pregledu (slika 12b) posle mesec dana vidimo značajnu progresiju i tipičnu sliku visokogradusnog tumora, što je potvrdilo nalaz spektroskopije.
Što se tiče detektovanja akutne ishemije i penumbre difuzioni i perfuzioni MRI su superiorne imidžing tehnike, ali i MR spektroskopija ima veliki potencijal za analizu nekoliko ključnih karakteristika mozga posle hiperakutne faze ishemije (4.5 sati). To su težina ishemijskog oštećenja, disfunkcija i stepen oštećenja neurona. Koncentracija NAA linearno opada u području ishemije tokom prvih 6 sati, što se usporava tokom narednih 24 sata. Koncentracija NAA u zahvaćenom parenhimu mozga može da padne ispod nivoa detekcije (108, 109). Veliki pad koncentracije NAA govori o ekstenzivnom infarktu i sindromu kliničke ishemije tj. lošijem kliničkom ishodu (110). Pad NAA na kontrolnoj MR spektroskopiji znači progresiju ishemije (111). Prisustvo laktata je znak hipoksije/ishemije, zato ovaj metabolit ima kliničku vrednost za analizu ishemije. Pojava laktata je karakteristična za akutnu ishemiju. Porast laktata u ishemijskom tkivu korelira sa finalnom veličinom ishemije i kliničkim ishodom (111).
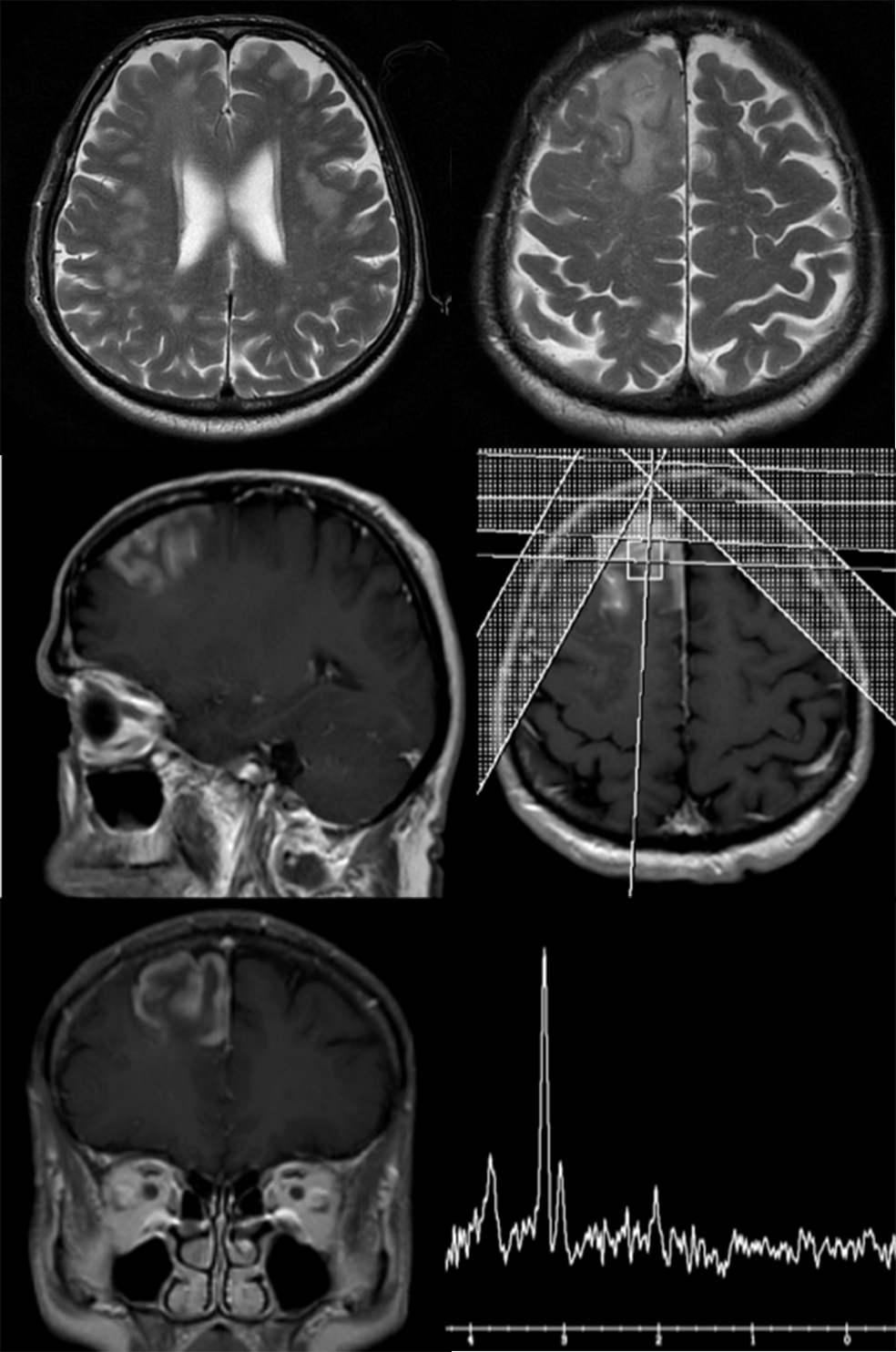
Slika 12a dati su MR imidži bolesnika sa vaskularnim lezijama koje su praćene tokom dužeg vremenskog perioda. Pacijent je razvio kliničku sliku koja je najviše odgovarala akutnoj ishemiji, u urgentnom centru je nakon CT i kliničkog pregleda dobio dijagnozu akutnog ishemijskog moždanog udara. Lezija u frontalnom lobusu desne hemisfere na konvencionalnim MR imidžima takođe ima sve karakteristike akutne ishemije, međutim spektroskopija govori u prilog visokogradusnog tumora.
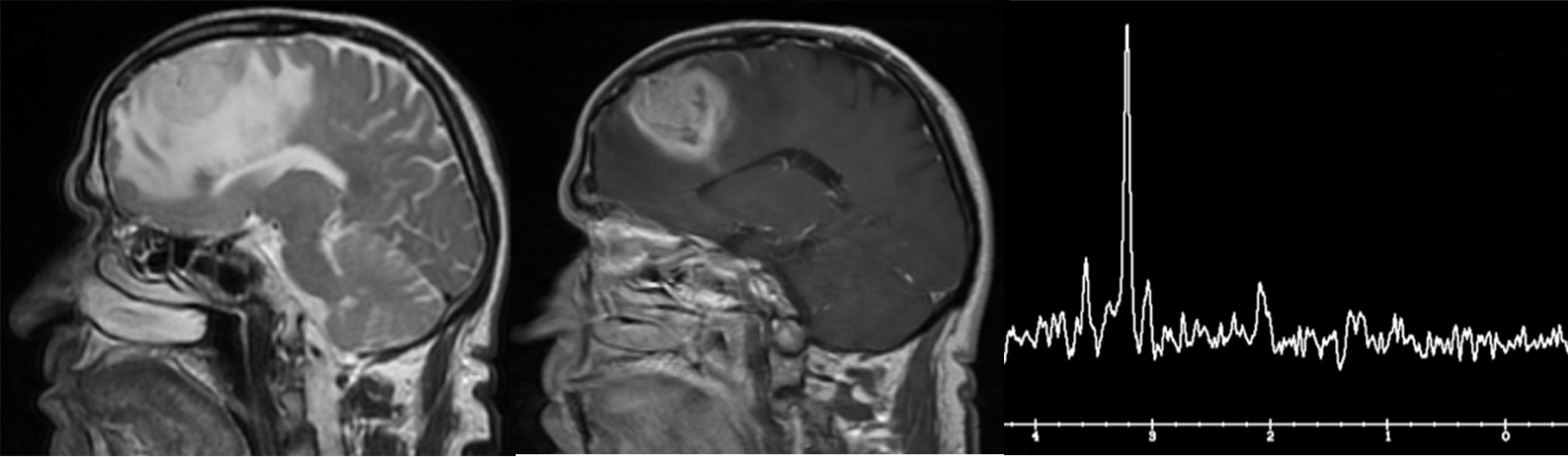
Slika 12b Na kontrolnom MRI pregledu posle mesec dana vidimo značajnu tumorsku progresiju i tipičnu sliku visokogradusnog tumora, što je potvrdilo nalaz spektroskopije.
Literatura:
- Aydin H, Sipahioğlu S, Oktay NA, Altin E, KizilgÃz V, Hekimoglu B. The value of proton MR-spectroscopy in the differentiation of brain tumours from non-neoplastic brain lesions. JBR-BTR. 2011; 94: 1-10
- Ross B, Michaelis T. Clinical applications of magnetic resonance spectroscopy. Magn Reson Q. 1994; 10: 191-247.
- Cousins JP. Clinical MR spectroscopy: fundamentals, current applications, and future potential. AJR Am J Roentgenol. 1995; 164: 1337-1347.
- Barker PB (2004) Fundamentals of MR spectroscopy. In: Clinical MR Neuroimaging. Diffusion, Perfusion and Spectroscopy. Gillard JH, Waldman AD, Barker PB (Eds.), Cambridge University Press, UK.
- Gülin Öz , Jeffry R. Alger, Peter B. Barker et al. Clinical Proton MR Spectroscopy in Central Nervous System Disorders. Radiology 2014 Mar;270(3):658-79. doi: 10.1148/radiol.13130531.
- Hourani R, Brant LJ, Rizk T, Weingart JD, Barker PB, Horska A. Can proton MR spectroscopic and perfusion imaging differentiate between neoplastic and nonneoplastic brain lesions in adults? AJNR Am J Neuroradiol 2008;29(2):366–372.
- Law M, Yang S, Wang H, et al. Glioma grading: sensitivity, specificity, and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging. AJNR Am J Neuroradiol 2003;24(10):1989–1998.
- Garcia-Gomez JM, Luts J, Julia-Sape M, et al. Multiproject-multicenter evaluation of automatic brain tumor classification by magnetic resonance spectroscopy. MAGMA 2009;22(1):5–18.
- Vicente J, Fuster-Garcia E, Tortajada S, et al. Accurate classification of childhood brain tumours by in vivo 1H MRS: a multi-centre study. Eur J Cancer 2013;49(3):658–667.
- Tate AR, Underwood J, Acosta DM, et al. Development of a decision support system for diagnosis and grading of brain tumours using in vivo magnetic resonance single voxelspectra. NMR Biomed 2006;19(4):411–434.
- Choi C, Ganji SK, DeBerardinis RJ, et al. 2-hydroxyglutarate detection by magnetic resonance spectroscopy in IDHmutated patients with gliomas. Nat Med 2012;18(4):624–629.
- Julia-Sape M, Coronel I, Majos C, et al. Prospective diagnostic performance evaluation of single-voxel 1H MRS for typing and grading of brain tumours. NMR Biomed 2012;25(4):661–673.
- Howe FA, Barton SJ, Cudlip SA, et al. Metabolic profiles of human brain tumors using quantitative in vivo 1H magnetic resonance spectroscopy. Magn Reson Med 2003;49(2):223–232.
- Opstad KS, Ladroue C, Bell BA, Griffiths JR, Howe FA. Linear discriminant analysis of brain tumour 1H MR spectra: a comparison of classification using whole spectra versus metabolite quantification. NMR Biomed 2007;20(8):763–770.
- Crawford FW, Khayal IS, McGue C, et al. Relationship of pre-surgery metabolic and physiological MR imaging parameters to survival for patients with untreated GBM. J Neurooncol 2009;91(3):337–351.
- Murphy PS, Rowland IJ, Viviers L, Brada M, Leach MO, Dzik-Jurasz AS. Could assessment of glioma methylene lipid resonance by in vivo 1H-MRS be of clinical value? Br J Radiol 2003;76(907):459–463.
- Poptani H, Gupta RK, Roy R, Pandey R, Jain VK, Chhabra DK. Characterization of intracranial mass lesions with in vivo proton MR spectroscopy. AJNR Am J Neuroradiol 1995;16(8):1593–1603.
- Kovanlikaya A, Panigrahy A, Krieger MD, et al. Untreated pediatric primitive neuroectodermal tumor in vivo: quantitation of taurine with MR spectroscopy. Radiology 2005;236(3):1020–1025.
- Davies NP, Wilson M, Natarajan K, et al. Non-invasive detection of glycine as a biomarker of malignancy in childhood brain tumours using in-vivo 1H MRS at 1.5 Tesla confirmed by ex-vivo high-resolution magic-angle spinning NMR. NMR Biomed 2010;23(1):80–87.
- McKnight TR, Lamborn KR, Love TD, et al. Correlation of magnetic resonance spectroscopic and growth characteristics within grades II and III gliomas. J Neurosurg 2007;106(4):660–666.
- Chang SM, Nelson S, Vandenberg S, et al. Integration of preoperative anatomic and metabolic physiologic imaging of newly diagnosed glioma. J Neurooncol 2009;92(3): 401–415.
- Chawla S, Zhang Y, Wang S, et al. Proton magnetic resonance spectroscopy in differentiating glioblastomas from primary cerebral lymphomas and brain metastases. J Comput Assist Tomogr 2010;34(6):836–841.
- Wijnen JP, Idema AJ, Stawicki M, et al. Quantitative short echo time 1H MRSI of the peripheral edematous region of human brain tumors in the differentiation between glioblastoma, metastasis, and meningioma. J Magn Reson Imaging 2012;36(5):1072–1082.
- Al-Okaili RN, Krejza J, Woo JH, et al. Intraaxial brain masses: MR imaging–based diagnostic strategy-initial experience. Radiology 2007;243(2):539–550.
- Hock A, Henning A, Boesiger P, Kollias SS. 1H-MR spectroscopy in the human spinal cord. AJNR Am J Neuroradiol 2013;34(9):1682–1689.
- Steffen-Smith EA, Shih JH, Hipp SJ, Bent R, Warren KE. Proton magnetic resonance spectroscopy predicts survival in children with diffuse intrinsic pontine glioma. J Neurooncol 2011;105(2):365–373.
- Bluml S, Panigrahy A, Laskov M, et al. Elevated citrate in pediatric astrocytomas with malignant progression. Neurooncol 2011;13(10):1107–1117.
- Wilson M, Cummins CL, Macpherson L, et al. Magnetic resonance spectroscopy metabolite profiles predict survival in paediatric brain tumours. Eur J Cancer 2013;49(2):457–464.
- Einstein DB, Wessels B, Bangert B, et al. Phase II trial of radiosurgery to magnetic resonance spectroscopy-defined high-risk tumor volumes in patients with glioblastoma multiforme. Int J Radiat Oncol Biol Phys 2012;84(3):668–674.
- Stadlbauer A, Moser E, Gruber S, et al. Improved delineation of brain tumors: an automated method for segmentation based on pathologic changes of 1H-MRSI metabolites in gliomas. Neuroimage 2004;23(2):454–461.
- Kallenberg K, Bock HC, Helms G, et al. Untreated glioblastoma multiforme: increased myo-inositol and glutamine levels in the contralateral cerebral hemisphere at proton MR spectroscopy. Radiology 2009;253(3):805–812.
- Scheenen TW, Klomp DW, Wijnen JP, Heerschap A. Short echo time 1H-MRSI of the human brain at 3T with minimal chemical shift displacement errors using adiabatic refocusing pulses. Magn Reson Med 2008;59(1):1–6.
- Fink JR, Carr RB, Matsusue E, et al. Comparison of 3 Tesla proton MR spectroscopy,MR perfusion and MR diffusion for distinguishing glioma recurrence from posttreatment effects. J Magn Reson Imaging 2012;35(1):56–63.
- Murphy PS, Viviers L, Abson C, et al. Monitoring temozolomide treatment of low-grade glioma with proton magnetic resonance spectroscopy. Br J Cancer 2004;90(4): 781–786.
- Prat R, Galeano I, Lucas A, et al. Relative value of magnetic resonance spectroscopy, magnetic resonance perfusion, and 2-(18F) fluoro-2-deoxy-D-glucose positron emission tomography for detection of recurrence or grade increase in gliomas. J Clin Neurosci 2010;17(1):50–53.
- Huppi PS, Posse S, Lazeyras F, Burri R, Bossi E, Herschkowitz N. Magnetic resonance in preterm and term newborns: 1Hspectroscopy in developing human brain. Pediatr Res 1991;30(6):574–578.
- van der Knaap MS, van der Grond J, van Rijen PC, Faber JA, Valk J, Willemse K. Age-dependent changes in localized proton and phosphorus MR spectroscopy of the brain. Radiology 1990;176(2):509–515.
- Hanefeld F, Bauer HJ, Christen HJ, Kruse B, Bruhn H, Frahm J. Multiple sclerosis in childhood: report of 15 cases. Brain Dev 1991;13(6):410–416.
- van der Knaap MS, Pouwels PJ. Magnetic resonance spectroscopy: basic principles and application in white matter disorders. In: van der Knaap MS, Valk J, eds. Magnetic resonance of myelination and myelin disorders. 3rd ed. Berlin, Germany: Springer, 2005; 859–880.
- Frahm J, Hanefeld F. Localized proton magnetic resonance spectroscopy of brain disorders in childhood. In: Bachelard HS, ed. Magnetic resonance spectroscopy and imaging in neurochemistry. New York, NY: Plenum, 1997; 329–402.
- Engelke U, Moolenaar S, Hoenderop S, et al. Handbook of 1H NMR spectroscopy in inborn errors of metabolism: body fluid NMR spectroscopy and in vivo MR spectroscopy. 2nd ed. Heilbronn, Germany: SPS Verlagsgesellschaft, 2007.
- Heindel W, Kugel H, Roth B. Noninvasive detection of increased glycine content by proton MR spectroscopy in the brains of two infants with nonketotic hyperglycinemia. AJNR Am J Neuroradiol 1993; 14(3):629–635.
- Detre JA, Wang ZY, Bogdan AR, et al. Regional variation in brain lactate in Leigh syndrome by localized 1H magnetic resonance spectroscopy. Ann Neurol 1991;29(2):218–221.
- Wilichowski E, Pouwels PJ, Frahm J, Hanefeld F. Quantitative proton magnetic resonance spectroscopy of cerebral metabolic disturbances in patients with MELAS. Neuropediatrics 1999;30(5):256–263.
- Bruhn H, Kruse B, Korenke GC, et al. Proton NMR spectroscopy of cerebral metabolic alterations in infantile peroxisomal disorders. J Comput Assist Tomogr1992;16(3):335–344.
- Zand DJ, Simon EM, Pulitzer SB, et al. In vivo pyruvate detected by MR spectroscopy in neonatal pyruvate dehydrogenase deficiency. AJNR Am J Neuroradiol 2003;24(7):1471–1474.
- Ghezzi D, Goffrini P, Uziel G, et al. SDHAF1, encoding a LYR complex-II specific assembly factor, is mutated in SDH-defective infantile leukoencephalopathy. Nat Genet 2009;41(6):654–656.
- Ohlenbusch A, Edvardson S, Skorpen J, et al. Leukoencephalopathy with accumulated succinate is indicative of SDHAF1 related complex II deficiency. Orphanet J Rare Dis 2012;7(1):69.
- Austin SJ, Connelly A, Gadian DG, Benton JS, Brett EM. Localized 1H NMR spectroscopy in Canavan’s disease: a report of two cases. Magn Reson Med 1991;19(2):439–445.
- Mercimek-Mahmutoglu S, Stockler-Ipsiroglu S, Salomons GS. Creatine deficiency syndromes. GeneReviews 2009. http://www.ncbi.nlm.nih.gov/books/NBK3794/. Updated August 18, 2011. Accessed April 27, 2012.
- Stockler S, Hanefeld F, Frahm J. Creatine replacement therapy in guanidinoacetate methyltransferase deficiency, a novel inborn error of metabolism. Lancet 1996;348(9030):789–790.
- Ndika JD, Johnston K, Barkovich JA, et al. Developmental progress and creatine restoration upon long-term creatine supplementation of a patient with arginine:glycine amidinotransferase deficiency. Mol Genet Metab 2012;106(1):48–54.
- van de Kamp JM, Pouwels PJ, Aarsen FK, et al. Long-term follow-up and treatment in nine boys with X-linked creatine transporter defect. J Inherit Metab Dis 2012; 35(1):141–149.
- Bizzi A, Bugiani M, Salomons GS, et al. X-linked creatine deficiency syndrome: a novel mutation in creatine transporter gene SLC6A8. Ann Neurol 2002;52(2):227–231.
- Wiame E, Tyteca D, Pierrot N, et al. Molecular identification of aspartate N-acetyltransferase and its mutation in hypoacetylaspartia. Biochem J 2010;425(1):127–136.
- Martin E, Capone A, Schneider J, Hennig J, Thiel T. Absence of N-acetylaspartate in the human brain: impact on neurospectroscopy? Ann Neurol 2001;49(4):518–521.
- Pouwels PJ, Brockmann K, Kruse B, et al. Regional age dependence of human brain metabolites from infancy to adulthood as detected by quantitative localized proton MRS. Pediatr Res 1999;46(4):474–485.
- Davison JE, Hendriksz CJ, Sun Y, Davies NP, Gissen P, Peet AC. Quantitative in vivo brain magnetic resonance spectroscopic monitoring of neurological involvement in mucopolysaccharidosis type II (Hunter syndrome). J Inherit Metab Dis 2010;33(Suppl 3):395–399.
- Davison JE, Davies NP, Wilson M, et al. MR spectroscopy–based brain metabolite profiling in propionic acidaemia: metabolic changes in the basal ganglia during acute decompensation and effect of liver transplantation. Orphanet J Rare Dis 2011;6:19.
- Aaen GS, Holshouser BA, Sheridan C, et al. Magnetic resonance spectroscopy predicts outcomes for children with nonaccidental trauma. Pediatrics 2010;125(2):295–303.
- Kreis R, Arcinue E, Ernst T, Shonk TK, Flores R, Ross BD. Hypoxic encephalopathy after near-drowning studied by quantitative 1H-magnetic resonance spectroscopy. J Clin Invest 1996;97(5):1142–1154.
- Bizzi A, Castelli G, Bugiani M, et al. Classification of childhood white matter disorders using proton MR spectroscopic imaging. AJNR Am J Neuroradiol 2008;29(7): 1270–1275.
- van der Voorn JP, Pouwels PJ, Hart AA, et al. Childhood white matter disorders: quantitative MR imaging and spectroscopy.Radiology 2006;241(2):510–517.
- Cartier N, Aubourg P. Hematopoietic stem cell gene therapy in Hurler syndrome, globoid cell leukodystrophy, metachromatic leukodystrophy and X-adrenoleukodystrophy.Curr Opin Mol Ther 2008;10(5):471–478.
- Oz G, Tkac I, Charnas LR, et al. Assessment of adrenoleukodystrophy lesions by high field MRS in non-sedated pediatric patients. Neurology 2005;64(3):434–441.
- Eichler FS, Barker PB, Cox C, et al. Proton MR spectroscopic imaging predicts lesion progression on MRI in X-linked adrenoleukodystrophy. Neurology 2002;58(6):901–907.
- Wilken B, Dechent P, Brockmann K, et al.Quantitative proton magnetic resonance spectroscopy of children with adrenoleukodystrophy before and after hematopoietic stem cell transplantation. Neuropediatrics 2003;34(5):237–246.
- Kruse B, Hanefeld F, Christen HJ, et al. Alterations of brain metabolites in metachromatic leukodystrophy as detected by localized proton magnetic resonance spectroscopy in vivo. J Neurol 1993;241(2):68–74.
- Eichler F, Grodd W, Grant E, et al. Metachromatic leukodystrophy: a scoring system for brain MR imaging observations. AJNR Am J Neuroradiol 2009;30(10):1893–1897.
- i Dali C, Hanson LG, Barton NW, Fogh J, Nair N, Lund AM. Brain N-acetylaspartate levels correlate with motor function in metachromatic leukodystrophy. Neurology 2010;75(21):1896–1903.
- Ding XQ, Bley A, Kohlschutter A, Fiehler J, Lanfermann H. Long-term neuroimaging follow-up on an asymptomatic juvenile metachromatic leukodystrophy patient after hematopoietic stem cell transplantation: evidence of myelin recovery and ongoing brain maturation. Am J Med Genet A 2012;158A(1):257-260.
- Arnold DL, Matthews PM, Francis G, Antel J. Proton magnetic resonance spectroscopy of human brain in vivo in the evaluation of multiple sclerosis: assessment of the load of disease. Magn Reson Med 1990;14(1):154–159.
- Richards TL. Proton MR spectroscopy in multiple sclerosis: value in establishing diagnosis, monitoring progression, and evaluating therapy. AJR Am J Roentgenol1991;157(5):1073–1078.
- Davie CA, Hawkins CP, Barker GJ, et al. Detection of myelin breakdown productsby proton magnetic resonance spectroscopy. Lancet 1993;341(8845):630–631.
- Hannoun S, Bagory M, Durand-Dubief F, et al. Correlation of diffusion and metabolic alterations in different clinical forms of multiple sclerosis. PLoS ONE 2012;7(3):e32525.
- Vrenken H, Barkhof F, Uitdehaag BM, Castelijns JA, Polman CH, Pouwels PJ. MR spectroscopic evidence for glial increase but not for neuro-axonal damage in MS normal-appearing white matter. Magn Reson Med 2005;53(2):256–266.
- De Stefano N, Narayanan S, Francis GS, et al. Evidence of axonal damage in the early stages of multiple sclerosis and its relevance to disability. Arch Neurol 2001;58(1): 65–70.
- Tartaglia MC, Narayanan S, De Stefano N, et al. Choline is increased in pre-lesional normal appearing white matter in multiple sclerosis. J Neurol 2002;249(10):1382–1390.
- De Stefano N, Filippi M, Miller D, et al. Guidelines for using proton MR spectroscopy in multicenter clinical MS studies. Neurology 2007;69(20):1942–1952.
- Gupta RK. Magnetic resonance spectroscopy in intracranial infection. In: Gillard JH, Waldman AD, Barker PB, eds. Clinical MR neuroimaging. 2nd ed. London, England: Cambridge University Press, 2010;426–454.
- Chang KH, Song IC, Kim SH, et al. In vivo single-voxel proton MR spectroscopy in intracranial cystic masses. AJNR Am J Neuroradiol 1998;19(3):401–405.
- Agarwal M, Chawla S, Husain N, Jaggi RS, Husain M, Gupta RK. Higher succinate than acetate levels differentiate cerebral degenerating cysticerci from anaerobic abscesses on in-vivo proton MR spectroscopy.Neuroradiology 2004;46(3):211–215.
- Sturrock A, Laule C, Decolongon J, et al. Magnetic resonance spectroscopy biomarkers in premanifest and early Huntington disease. Neurology 2010;75(19):1702–1710.
- Kantarci K, Jack CR Jr, Xu YC, et al. Regional metabolic patterns in mild cognitive impairment and Alzheimer’s disease:a 1H MRS study. Neurology 2000;55(2):210–217.
- Adalsteinsson E, Sullivan EV, Kleinhans N, Spielman DM, Pfefferbaum A. Longitudinal decline of the neuronal marker N-acetyl aspartate in Alzheimer’s disease. Lancet 2000;355(9216):1696–1697.
- Oz G, Hutter D, Tkac I, et al. Neurochemical alterations in spinocerebellar ataxia type 1 and their correlations with clinical status. Mov Disord 2010;25(9):1253–1261.
- Unschuld PG, Edden RA, Carass A, et al. Brain metabolite alterations and cognitive dysfunction in early Huntington’s disease.Mov Disord 2012;27(7):895–902.
- Kantarci K, Weigand SD, Petersen RC, et al. Longitudinal 1H MRS changes in mild cognitive impairment and Alzheimer’s disease.Neurobiol Aging 2007;28(9):1330–1339.
- Griffith HR, Stewart CC, den Hollander JA.Proton magnetic resonance spectroscopy in dementias and mild cognitive impairment. Int Rev Neurobiol 2009;84:105–131.
- Rupsingh R, Borrie M, Smith M, Wells JL, Bartha R. Reduced hippocampal glutamate in Alzheimer disease. Neurobiol Aging 2011;32(5):802–810.
- Oz G, Iltis I, Hutter D, Thomas W, Bushara KO, Gomez CM. Distinct neurochemical profiles of spinocerebellar ataxias 1, 2, 6, and cerebellar multiple system atrophy. Cerebellum 2011;10(2):208–217.
- Miller BL, Moats RA, Shonk T, Ernst T, Woolley S, Ross BD. Alzheimer disease: depiction of increased cerebral myo-inositol with proton MR spectroscopy. Radiology 1993;187(2):433–437.
- Ross BD, Bluml S, Cowan R, Danielsen E, Farrow N, Tan J. In vivo MR spectroscopy of human dementia. Neuroimaging Clin N Am 1998;8(4):809–822.
- Godbolt AK, Waldman AD, MacManus DG, et al. MRS shows abnormalities before symptoms in familial Alzheimer disease. Neurology 2006;66(5):718–722.
- Kantarci K, Boeve BF, Wszolek ZK, et al. MRS in presymptomatic MAPT mutation carriers: a potential biomarker for taumediated pathology. Neurology 2010;75(9):771–778.
- Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med 2000; 342(5):314–319.
- Del Felice A, Beghi E, Boero G, et al. Early versus late remission in a cohort of patients with newly diagnosed epilepsy. Epilepsia 2010;51(1):37–42.
- Wiebe S, Jette N. Epilepsy surgery utilization: who, when, where, and why? Curr Opin Neurol 2012;25(2):187–193.
- Englot DJ, Wang DD, Rolston JD, Shih TT, Chang EF. Rates and predictors of longterm seizure freedom after frontal lobe epilepsy surgery: a systematic review and meta-analysis. J Neurosurg 2012;116(5):1042–1048.
- Siesjo BK. Brain energy metabolism. London, England: Wiley, 1978.
- Ristić AJ, Ostojić J, Kozić D, Vojvodić NM, Popović LJM, Janković S, Baščarević V, Sokić DV. Hippocampal metabolic dysfunction in juvenile myoclonic epilepsy: 3D multivoxel spectroscopy study. Journal of the Neurological Sciences 2011;305:139-142.
- Capizzano AA, Vermathen P, Laxer KD, et al. Temporal lobe epilepsy: qualitative reading of 1H MR spectroscopic images for presurgical evaluation. Radiology 2001;218(1):144–151.
- Connelly A, Jackson GD, Duncan JS, King MD, Gadian DG. Magnetic resonance spectroscopy in temporal lobe epilepsy. Neurology 1994;44(8):1411–1417.
- Simister RJ, McLean MA, Barker GJ, Duncan JS. Proton MR spectroscopy of metabolite concentrations in temporal lobe epilepsy and effect of temporal lobe resection. Epilepsy Res 2009;83(2-3):168–176.
- Maudsley AA, Domenig C, Ramsay RE, Bowen BC. Application of volumetric MR spectroscopic imaging for localization of neocortical epilepsy. Epilepsy Res 2010;88(2-3):127–138.
- Willmann O, Wennberg R, May T, Woermann FG, Pohlmann-Eden B. The role of 1H magnetic resonance spectroscopy in preoperative evaluation for epilepsy surgery: ameta-analysis. Epilepsy Res 2006;71(2-3): 149–158.
- Cross JH, Connelly A, Jackson GD, Johnson CL, Neville BG, Gadian DG. Protonmagnetic resonance spectroscopy in children with temporal lobe epilepsy. Ann Neurol 1996;39(1):107–113.
- Bruhn H, Frahm J, Gyngell ML, Merboldt KD, Hanicke W, Sauter R. Cerebral metabolism in man after acute stroke: new observations using localized proton NMR spectroscopy. Magn Reson Med 1989;9(1):126–131.
- Saunders DE. MR spectroscopy in stroke.Br Med Bull 2000;56(2):334–345.
- Wardlaw JM, Marshall I, Wild J, Dennis MS, Cannon J, Lewis SC. Studies of acute ischemic stroke with proton magnetic resonance spectroscopy: relation between time from onset, neurological deficit, metabolite abnor malities in the infarct, blood flow, and clinical outcome. Stroke 1998;29(8):1618–1624.
- Parsons MW, Li T, Barber PA, et al. Combined 1H MR spectroscopy and diffusion weighted MRI improves the prediction of stroke outcome. Neurology 2000;55(4):498–505.